
����Ŀ��ͭ����������ʹ�õĽ���֮һ����������֪ʶ�ش��������⣺
��1�����ӹ�ҵ����30%��FeCl3��Һ��ʴ���ھ�Ե���ϵ�ͭ��������ӡˢ��·�壬д��FeCl3��Һ�����ͭ������Ӧ�����ӷ���ʽ__________________________��
��2��ͭ����Ũ���ᷴӦ��д����Ӧ�Ļ�ѧ����ʽ_______________________;�����ɵ�����ͨ������ˮ��Һ�У�������Ϊ__________________________��
��3��ͭ����Ũ���ᷴӦ��д����Ӧ�����ӷ���ʽ___________________���ø�����Թܼ���NO2(��״���£���������ˮ���У���������Թ��ڵ���Һ����ɢ��ˮ���У����Թ������ʵ����ʵ���Ũ����______________________molL-1��
��4����ҵ�ϻ���ͭ�����з�������Ҫ��ӦΪ��2Cu2O+Cu2S=6Cu+SO2����������19.2 g Cuʱ����Ӧת�Ƶ���_________________mol��
���𰸡� 2Fe3+ +Cu=2Fe2+ +Cu2+ 2H2SO4(Ũ��+ Cu ![]() CuSO4 + SO2�� +2H2O ��������ɫ���� Cu+4H+ +2NO3-=Cu2+ +2NO2��+2H2O 045 molL-1��1/22.4 molL-1) 0.3
CuSO4 + SO2�� +2H2O ��������ɫ���� Cu+4H+ +2NO3-=Cu2+ +2NO2��+2H2O 045 molL-1��1/22.4 molL-1) 0.3
����������1��FeCl3��Һ�����ͭ������Ӧ�����ӷ���ʽΪ2Fe3+ +Cu=2Fe2+ +Cu2+����2��ͭ����Ũ���ᷴӦ����Ӧ�Ļ�ѧ����ʽΪ2H2SO4(Ũ��+Cu![]() CuSO4 + SO2�� +2H2O������������������ԣ������ɵ�����ͨ������ˮ��Һ�У����߷�Ӧ���ɵ������ˮ��������Ϊ��������ɫ��������3��ͭ����Ũ���ᷴӦ����Ӧ�����ӷ���ʽΪCu+4H++2NO3-��Cu2++2NO2��+2H2O���ø�����Թܼ���NO2(��״���£���������ˮ���У�������Ӧ3NO2+H2O��2HNO3+NO�����Թ������ʵ����ʵ���Ũ����
CuSO4 + SO2�� +2H2O������������������ԣ������ɵ�����ͨ������ˮ��Һ�У����߷�Ӧ���ɵ������ˮ��������Ϊ��������ɫ��������3��ͭ����Ũ���ᷴӦ����Ӧ�����ӷ���ʽΪCu+4H++2NO3-��Cu2++2NO2��+2H2O���ø�����Թܼ���NO2(��״���£���������ˮ���У�������Ӧ3NO2+H2O��2HNO3+NO�����Թ������ʵ����ʵ���Ũ����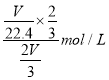 ��molL-1����4����Ӧ��ͭԪ�ػ��ϼ۴�+1�۽��͵�0�ۣ��õ�1�����ӣ�19.2gͭ�����ʵ�����19.2g��64g/mol��0.3mol�����Է�Ӧת�Ƶ���0.3mol���ӡ�
��molL-1����4����Ӧ��ͭԪ�ػ��ϼ۴�+1�۽��͵�0�ۣ��õ�1�����ӣ�19.2gͭ�����ʵ�����19.2g��64g/mol��0.3mol�����Է�Ӧת�Ƶ���0.3mol���ӡ�


 ��Ȥ������ҵ���ϿƼ�������ϵ�д�
��Ȥ������ҵ���ϿƼ�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Z�����·�Ӧ�õ���C4H9Br ![]() Y
Y ![]() Z��Z�Ľṹ��ʽ�������ǣ� ��
Z��Z�Ľṹ��ʽ�������ǣ� ��
A.CH3CH2CHBrCH2Br
B.CH3CH��CH2Br��2
C.CH3CHBrCHBrCH3
D.CH2BrCBr��CH3��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������Ľṹ��ʽ��ͼ������˵��������ǣ� �� ![]()
A.������ķ���ʽΪC9H12
B.������ķе�ȱ���
C.�������̼ԭ�ӿ��ܶ�����ͬһƽ��
D.������ͱ�Ϊͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����˵������ȷ���ǣ� ��
A.�����������Ӽ״��û��ȼ�ϵ���ֵ����
B.�����ԭˮ����ȵ��ˮ��������ܻ�����������
C.������ˮ����NH4+��NH3�����û�ѧ��������绯ѧ����������
D.ij�ֹ�ѧ��⼼�����м��ߵ������ȣ��ɼ�����ϸ����V��10��12L���ڵ�����Ŀ����ӣ��ݴ˿�����ü�⼼���ܲ���ϸ����Ũ��ԼΪ10��12��10��11molL��1��Ŀ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�������У���ij��̼ԭ������4����ͬ��ԭ�ӻ�ԭ���ţ�������̼ԭ�ӳ�Ϊ������̼ԭ�ӡ�������һ������̼ԭ�ӵ�����һ�����й�ѧ���ԣ������й�ѧ���ԣ����������з�Ӧ�����ɵ��л������й�ѧ���Ե��ǣ� �� 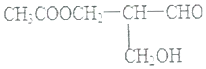
A.��NaOH��Һ����
B.����ᷢ��������Ӧ
C.�����Cu��OH��2����Һ��Ӧ
D.�ڴ�����������H2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ��Ƥ������ҩ����������ԭ��X�����ಽ��Ӧ�ϳɣ�����˵������ȷ���ǣ� �� 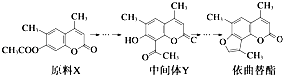
A.ԭ��X���м���Y��Ϊͬ���칹��
B.ԭ��X����ʹ����KMnO4��Һ��ɫ
C.�м���Y�ܷ����ӳɡ�ȡ������ȥ��Ӧ
D.1 mol��������ֻ����2 mol NaOH������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
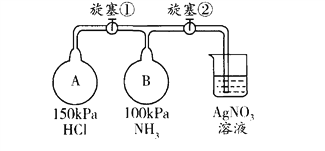
����Ŀ��������ͼװ�ã��г�װ���ԣ���ȡ���ռ�����������İ�������̽�� ���������ʡ�

��1���ر�װ��I�е�ֹˮ�У����Һ©���м�������ˮ��������˵��װ��I ���������õ�������____________________________________________________��
��2������װ��I��ȡ������Ӧѡ�õ��Լ�ΪŨ��ˮ_______ �� ______(����ţ���
A.���Ȼ��� B.Ũ���� C.����� D.��ʯ��
��3������ʵ��Ҫ���������ӵ�˳������ĸ��ű�ʾ����a��_____�� �� �� �� ��
��4��������ͨ��ʢ������ͭ��ĩ�IJ������У������к�ɫ�������ɫ���嵥�����ɣ�֤����������_____________�ԣ���Ӧ�Ļ�ѧ����ʽ��__________________________________��
��5���ռ�����������ͼ����װ�ý���ʵ�顣�ȴ������٣�Bƿ�в�����ɫ���̣�ԭ����______________________ (�û�ѧ����ʽ��ʾ�����ȶ��ر������٣��ٴ�������ڣ�Bƿ�е�������___________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��MnSO4�ڹ�ҵ������ҪӦ�ã������̿���Ҫ�ɷ�ΪMnO2��ˮ������Fe2O3��FeO��Al2O3������PbO�����ʣ������Ʊ�MnSO4 �� ��������£� I�� �����̿���ͨ��SO2 �� �̡���������ǦԪ����������ʽ��������ý���Һ��pH��2��
II�� �����Һ�м�MnO2 �� ��ַ�Ӧ����ʯ���飬����ҺpH=4.7��
III���ټ��������������������ú���ˣ�
IV����Һ����Ũ������ȴ�ᾧ�����MnSO4���壮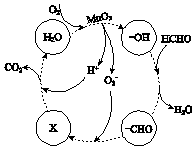
�����ϡ������������γ��������������pH
���� | Fe2+ | Fe3+ | Al3+ | Mn2+ | Pb2+ |
��ʼ����ʱ��pH | 7.6 | 2.7 | 3.8 | 8.3 | 8.0 |
��ȫ����ʱ��pH | 9.7 | 3.7 | 4.7 | 9.8 | 8.8 |
��1��I�������̿���ͨ��SO2����MnSO4 �� �÷�Ӧ�Ļ�ѧ����ʽ�� ��
��2��II �м���MnO2����ҪĿ����������Һ pH=4.7�����ɵij�����Ҫ���� ������CaSO4 ��
��3��III�м�������������������Ҫ��ȥ�������� ��
��4���ö��Ե缫���MnSO4��Һ�������Ƶø���MnO2 �� �ٵ��MnSO4��Һ�����ӷ���ʽ��
�ڸ���MnO2�����ڴ������ȩ���й����ı仯��ͼ��ʾ������X�� �� �ܷ�Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ճ�����������ˮ���ǣ�Ҫ��õ������ˮ�����ã� ����ˮ��
A.̼������
B.̼����
C.����
D.�Ȼ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com