
| 温度/℃ | 25 | T1 | T2 |
| 水的离子积常数 | 1×10-14 | a | 1×10-12 |
 =10-2,10-1V2-10-1V1=10-2V2+10-2V1,即9×10-2V2=11×10-2V1,
=10-2,10-1V2-10-1V1=10-2V2+10-2V1,即9×10-2V2=11×10-2V1,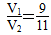 ,所以c(Na+)>c(SO42—)>c(H+)>c(OH-),(4)硫酸的pH为-lg
,所以c(Na+)>c(SO42—)>c(H+)>c(OH-),(4)硫酸的pH为-lg ,硫酸铝的pH=-lg1.0×10-b,
,硫酸铝的pH=-lg1.0×10-b, =1.0×10-b,所以a+b=14。
=1.0×10-b,所以a+b=14。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题

| A.曲线I中滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B.曲线I中滴加溶液到25 mL时:c(NH4+)>c(C1-)>c(H+)>c(OH-) |
| C.曲线II中滴加溶液在10 mL~25 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) |
| D.曲线II中滴加溶液到10mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.水的离子积通常用KW来表示,随温度变化而变化,只适用于纯水,在稀盐酸中数值会变大 |
| B.在纯水中加入硫酸会抑制水的电离,加醋酸会促进水的电离 |
| C.盐溶于水对水的电离平衡均没有影响 |
| D.在纯水中加入氢氧化铁固体对水的电离平衡会有微弱的影响 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.推广“低碳经济”,减少温室气体的排放 |
| B.推进小火力发电站的兴建,缓解地方用电困难,促进地方经济的快速发展 |
| C.推广“绿色自由”计划,吸收空气中的CO2并利用廉价能源合成汽油 |
| D.利用晶体硅制作的太阳能电池可将太阳能直接转化为电能 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
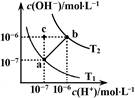
| A.ab线上任意点溶液均显中性 |
| B.b点时,溶液的pH=6,显酸性 |
| C.图中温度T1>T2 |
| D.在水中通入适量HCl气体可从a点变到c点 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
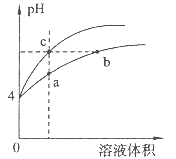
| A.a、c两点溶液的导电能力相同 |
| B.b点溶液中c(H+)+c(NH3·H2O)=c(OH-) |
| C.a、b、c三点溶液中水的电离程度a>b>c |
| D.用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb=Vc |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1:60 | B.3:1 | C.100:l | D.1:100 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com