
【题目】常温时,1mol/L的HA和1mol/L的HB两种酸溶液,起始时的体积均为V0,分别向两溶液中加水进行稀释,所得变化关系如图所示(V表示溶液稀释后的体积)。下列说法错误的是
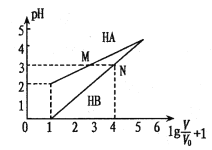
A. Ka( HA)约为10-4
B. 当两溶液均稀释至![]() 时,溶液中
时,溶液中![]() >
>![]()
C. 中和等体积pH相同的两种酸所用n(NaOH):HA>HB
D. 等体积、等物质的量浓度的NaA和NaB溶液中离子总数前者小于后者
【答案】B
【解析】
根据图示,当lg(V/V0)+1=1时,即V=V0,溶液还没稀释,1mol/L的HA溶液pH=2,即HA为弱酸,溶液中部分电离;1mol/L的HB溶液pH=0,即HB为强酸,溶液中全部电离。因为起始两溶液浓度和体积均相等,故起始两溶液中所含一元酸的物质的量相等。
A.1mol/L的HA溶液的pH为2,c(A-)=c(H+)=0.01mol/L,c(HA) ![]() 1mol/L,则HA的电离常数约为10-4,A正确;
1mol/L,则HA的电离常数约为10-4,A正确;
B. 由电荷守恒有:c(H+)=c(A-)+c(OH-),c(H+)=c(B-)+c(OH-),当两溶液均稀释至![]() 时,HB溶液pH=3,HA溶液pH>3,则有c(A-)<c(B-),B错误;
时,HB溶液pH=3,HA溶液pH>3,则有c(A-)<c(B-),B错误;
C.HA为弱酸,HB为强酸,等体积pH相同的两种酸所含一元酸的物质的量n(HA)>n(HB),故分别用NaOH溶液中和时,消耗的NaOH物质的量:HA>HB,C正确;
D.等体积、等物质的量浓度的NaA和NaB溶液,Na+数目相同,HA为弱酸,盐溶液中A-发生水解,NaA溶液呈碱性,NaA溶液中的电荷守恒为c(Na+)+c(H+)=c(A-)+c(OH-),HB为强酸,盐溶液中B-不发生水解,NaB溶液呈中性,NaB溶液中的电荷守恒为c(Na+)+c(H+)=c(B-)+c(OH-),NaA溶液中c(H+)<NaB溶液中c(H+),所以等体积、等物质的量浓度的NaA和NaB溶液中离子总数前者小于后者,D正确。
答案:B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)= CO2(g)ΔH1;C(s)+ ![]() O2(g)= CO(g)ΔH2
O2(g)= CO(g)ΔH2
②S(s)+O2(g)= SO2(g)ΔH3;S(g)+O2(g)=SO2(g)ΔH4
③H2(g)+ ![]() O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
④CaCO3(s)= CaO(s)+CO2(g)ΔH7;CaO(s)+H2O(l)= Ca(OH)2(s)ΔH8
A.①B.④C.②③④D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半,下列说法正确的是( )
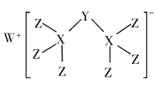
A.氧化物对应的水化物的酸性:Z> Y> X
B.元素X可与元素W形成化合物W2X,该化合物与水能产生可燃气体
C.该新化合物中Y不满足8电子稳定结构
D.Z氢化物的沸点一定比X氢化物的佛点高.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰是一种重要的化工中间体,是锰行业研究的热点。一种以高硫锰矿(主要成分为含锰化合物及FeS)为原料制备硫酸锰的工艺流程如下:
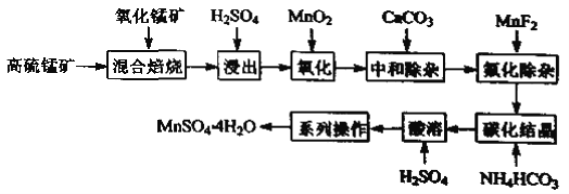
已知:①“混合焙烧”后烧渣含MnSO4、Fe2O3及少量FeO、Al2O3、MgO。
②金属离子在水溶液中的平衡浓度与pH的关系如图所示(25℃):
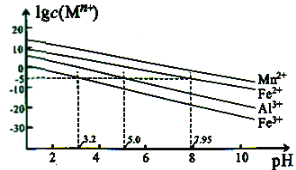
③此实验条件下Mn2+开始沉淀的pH为7.54;当离子浓度≤105mol·L1时,可认为离子沉淀完全。
请回答:
(1)传统工艺处理高硫锰矿时,不经“混合焙烧”,而是直接用H2SO4浸出,其缺点为____。
(2)“氧化”时,发生反应的离子方程式为____。若省略“氧化”步骤,造成的后果是____。
(3)“中和除杂”时,生成沉淀的主要成分为____(填化学式)。
(4)“氟化除杂”时,若使溶液中的Mg2+和Ca2+沉淀完全,需维持c(F-)不低于____。(已知:Ksp(MgF2)=6.4×1010;Ksp(CaF2)=3.6×1012)
(5)“碳化结晶”时,发生反应的离子方程式为_____。
(6)用惰性电极电解MnSO4溶液可制备MnO2,电解过程中阳极的电极反应式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置示意图如图所示。下列说法不正确的是( )
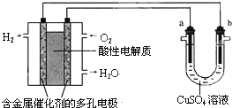
A.燃料电池工作时,正极反应为O2+4H++4e﹣=2H2O
B.a极是铜,b极是铁时,可实现铁上镀铜
C.a极是含锌、铁的粗铜,b极是纯铜,a极溶解铜的质量与b极析出的铜质量相等
D.若a、b两极均为石墨时,在相同条件下,a极产生的气体与电池中消耗的H2体积不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴是一种中等活泼金属,化合价为+2价和+3价,其中CoC12易溶于水。某校同学设计实验制取(CH3COO)2Co(乙酸钴)并验证其分解产物。回答下列问题:
(1)甲同学用Co2O3与盐酸反应制备CoC124H2O,其实验装置如下:

①烧瓶中发生反应的离子方程式为______。
②由烧瓶中的溶液制取干燥的CoC124H2O,还需经过的操作有蒸发浓缩、______、洗涤、干燥等。
(2)乙同学利用甲同学制得的CoC124H2O在醋酸氛围中制得无水(CH3COO)2Co,并利用下列装置检验(CH3COO)2Co在氮气气氛中的分解产物。已知PdC12溶液能被CO还原为Pd。

①装置E、F是用于检验CO和CO2的,其中盛放PdC12溶液的是装置______(填“E”或“F”)。
②装置G的作用是______;E、F、G中的试剂均足量,观察到I中氧化铜变红,J中固体由白色变蓝色,K中石灰水变浑浊,则可得出的结论是______。
③通氮气的作用是______。
④实验结束时,先熄灭D和I处的酒精灯,一段时间后再关闭弹簧夹,其目的是______。
⑤若乙酸钴最终分解生成固态氧化物X、CO、CO2、C2H6,且n(X):n(CO):n(CO2):n(C2H6)=1:4:2:3(空气中的成分不参与反应),则乙酸钴在空气气氛中分解的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极电解200mLH2SO4和CuSO4的混合溶液,通电一段时间后,两极均收集到2.24L气体(标准状况),原混合溶液中Cu2+的物质的量浓度为( )
A.0.2mol·L-1B.0.3mol·L-1C.0.4mol·L-1D.0.5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为四种短周期元素,它们的原子序数依次增大。A与其他几种元素均不在同一周期;B元素最高价氧化物对应的水化物能与其最简单氢化物反应生成一种盐X;C能形成两种常温下为液态的氢化物;D与C同主族。则下列说法中不正确的是( )
A.原子半径大小关系:A<C<B
B.在0.1molL-1的X溶液中,溶液中阳离子的数目小于0.1NA
C.C、D两种元素分别与A形成的最简单化合物的沸点C比D的要高
D.化合物X受热易分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.2 mol·L-1的KOH溶液与0.1 mol·L-1的H2SO3溶液等体积混合后,溶液中各粒子浓度大小关系正确的是( )
A.c(K+)+c(H+)=c(OH-)+c(![]() )+c(
)+c(![]() )
)
B.2c(K+)=c(![]() )+c(
)+c(![]() )+c(H2SO3)
)+c(H2SO3)
C.c(K+)>c(![]() )>c(
)>c(![]() )>c(H2SO3)
)>c(H2SO3)
D.c(![]() )+c(
)+c(![]() )+c(H2SO3)=0.1 mol·L-1
)+c(H2SO3)=0.1 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com