
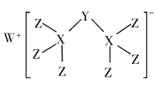
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半,下列说法正确的是( )
A.氧化物对应的水化物的酸性:Z> Y> X
B.元素X可与元素W形成化合物W2X,该化合物与水能产生可燃气体
C.该新化合物中Y不满足8电子稳定结构
D.Z氢化物的沸点一定比X氢化物的佛点高.
【答案】D
【解析】
W、X、Y、Z为同一短周期元素,根据图知,X能形成4个共价键、Z能形成1个共价键,则X位于第IVA族、Z位于第VIIA族,且Z核外最外层电子数是X核外电子数的一半,Z最外层7个电子,则X原子核外有14个电子,X为Si元素,Z为Cl元素,该阴离子中Cl元素为-1价、X元素为+4价,根据化合价的代数和为-1价可知,Y为-3价,所以Y为P元素,根据阳离子所带电荷知,W为Na元素。
A. Z为Cl、Y为P、X为Si,最高价氧化物对应的水化物依次为:HClO4、H3PO4、H2SiO3,其酸性为:HClO4>H3PO4>H2SiO3,A错误;
B. X为Si、W为Na,形成化合物Na4Si,与水反应生成氢气,其化学反应方程式为:Na4Si + 5H2O = Na2SiO3 + 2NaOH + 4H2 ↑,B错误;
C. Y为P,其最外层有5个电子,P原子形成2个共价键且该阴离子得到W原子一个电子,所以P原子达到8电子结构,C错误;
D. Z为Cl、X为Si,其对应的氢化物分别为:HCl、SiH4,沸点:HCl>SiH4,D正确;
答案为D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】常温时,向20mL 0.1 mol/L的CH3COOH溶液中逐滴滴加0.1 mol/L的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化如图所示。下列说法正确的是
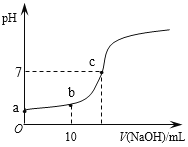
A. a点的pH=1
B. b点时,c (CH3COO—)=0.05mol/L
C. c点时,V(NaOH)=20mL
D. 反应过程中![]() 的值不断增大
的值不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】α1和α2,c1和c2分别为两个恒容容器中平衡体系N2O4(g)![]() 2NO2(g)和3O2(g)
2NO2(g)和3O2(g)![]() 2O3(g)的反应物转化率及反应物的平衡浓度,在温度不变的情况下,均增加反应物的物质的量,下列判断正确的是
2O3(g)的反应物转化率及反应物的平衡浓度,在温度不变的情况下,均增加反应物的物质的量,下列判断正确的是
A. α1、α2均减小,c1、c2均增大
B. α1、α2均增大,c1、c2均减小
C. α1减小,α2增大,c1、c2均增大
D. α1减小,α2增大,c1增大,c2减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液中粒子浓度关系正确的是( )
A.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-)
B.pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-)
C.常温下,0.1molL-1的①NH4Cl②CH3COONH4③NH4HSO4溶液中:c(NH4+)大小顺序:①>②>③
D.物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是( )

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液碱性增强
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 阴极区溶液pH降低,阳极区溶液pH升高
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸在生活和生产中应用广泛。某工厂以黄铁矿(主要成分为FeS2)为原料,采用接触法制备硫酸。
(1)已知在298 K和101 kPa条件下:
FeS2(s)=FeS(s)+S(s) H1
S(s)+ O2(g)=SO2(g) H2
4FeS(s)+7O2(g)=2Fe2O3(s) +4SO2(g) H3
则在该条件下FeS2与O2生成Fe2O3和SO2的热化学方程式为_______。
(2)催化氧化反应:2SO2(g) +O2(g)![]() 2SO3(g) H<0。在体积可变的密闭容器中,维持压强为101 kPa和初始n(SO2)=2mol,充入一定量的O2,SO2的平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图所示:
2SO3(g) H<0。在体积可变的密闭容器中,维持压强为101 kPa和初始n(SO2)=2mol,充入一定量的O2,SO2的平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图所示:
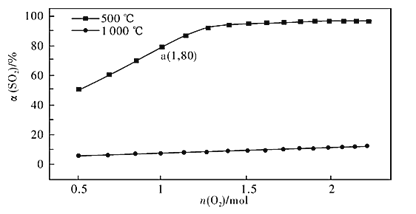
①在1000℃时,SO2平衡转化率随着O2物质的量的增大缓慢升高,解释其原因________。
②a点时SO3的平衡分压p(SO3)=_________Pa(保留两位有效数字,某组分的平衡分压=总压×某组分的物质的量分数)。
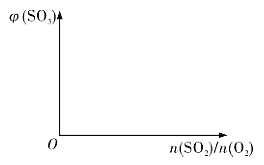
(3)保持温度不变,向固定体积的密闭容器中充入一定量的SO2、O2。请画出平衡体系中SO3的体积分数φ(SO3)随初始SO2、O2的物质的量之比[n(SO2)/n(O2)]的变化趋势图______:
(4)已知活性氧可以把SO2快速氧化为SO3,根据计算机模拟结果,在炭黑表面上O2转化为活性氧的反应历程与能量变化关系如图所示。下列说法不正确的是_______(填字母代号)。
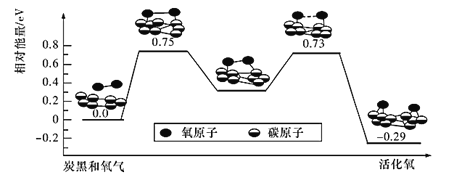
A.O2转化为活性氧是氧氧键的断裂与碳氧键的生成过程
B.该过程的最大能垒(活化能)E正=0.73 eV
C.每活化一个O2分子最终吸收0. 29 eV能量
D.依题炭黑可以作为SO2转化为SO3的催化剂
E.其他条件相同时,炭黑颗粒越小,反应速率越快
(5)硫酸工厂尾气中的SO2可被NaOH溶液吸收,用惰性电极将所得的Na2SO3溶液进行电解,可循环再生NaOH的同时得到H2SO4,写出阳极的电极反应式:___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:在298K、100kPa时,
①C(s,石墨)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1;
②2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1;
③2C2H2(g)+5O2(g)=4CO2(g)+ 2H2O(l) △H3=-2599kJ·mol-1;
则反应2C(s,石墨)+H2(g)=C2H2(g)的反应热△H为( )
A.-237.46kJ·mol-1B.+226.7kJ·mol-1
C.-226.7kJ·mol-1D.+237.46kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,1mol/L的HA和1mol/L的HB两种酸溶液,起始时的体积均为V0,分别向两溶液中加水进行稀释,所得变化关系如图所示(V表示溶液稀释后的体积)。下列说法错误的是
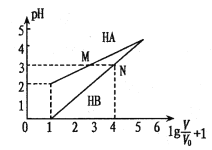
A. Ka( HA)约为10-4
B. 当两溶液均稀释至![]() 时,溶液中
时,溶液中![]() >
>![]()
C. 中和等体积pH相同的两种酸所用n(NaOH):HA>HB
D. 等体积、等物质的量浓度的NaA和NaB溶液中离子总数前者小于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型储氢材料是开发利用氢能的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Cl原子中,电子占据的最高电子层符号为__,该电子层具有的原子轨道数为__。
②LiBH4由Li+和BH4-构成,BH4-的立体构型是__,B原子的杂化轨道类型是___。
③Li、B元素的电负性由小到大的顺序为___。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+__H-(填“>”“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
I1/kJ·mol-1 | I2/kJ·mol-1 | I3/kJ·mol-1 | I4/kJ·mol-1 | I5/kJ·mol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是__族元素。
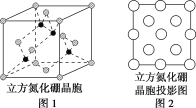
(3)图2是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和涂“![]() ”分别标明B与N的相对位置___。
”分别标明B与N的相对位置___。
(4)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm,Na+半径为102pm,H-的半径为__,NaH的理论密度是__g·cm-3(保留3个有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com