
����Ŀ������ʽ��������������Na2SO4��ˮ��ԭ����ͼ��ʾ�����ö����缫��ab��cd��Ϊ���ӽ���Ĥ����ֱ���糡�������£���Ĥ�м��Na+��SO42-��ͨ�����ӽ���Ĥ�������˸��������ӱ��赲���ܽ����м���ҡ�����������ȷ���ǣ�������

A. ͨ����м���ҵ�SO42-����������Ǩ�ƣ���������Һ������ǿ
B. �÷��ڴ�����Na2SO4��ˮʱ���Եõ�NaOH��H2SO4��Ʒ
C. ��������ҺpH���ͣ���������ҺpH����
D. ����·��ͨ��1mol���ӵĵ���ʱ������0.5mol��O2����
���𰸡�B
��������
A.�������������������������ƶ������������������ӷŵ磬�����������Լ�������A����
B.ֱ���糡�������£���Ĥ�м��Na+��SO42-��ͨ�����ӽ���Ĥ�������˸��������ӱ��赲���ܽ����м���ң�ͨ��ʱ���������������������ŵ�Ӷ��ƻ�ˮ�ĵ���ƽ�����������ӣ���Ĥ�м������������ڵ糡�������½������������������������������������õ����ƻ�ˮ�ĵ���ƽ���������������ӣ���Ĥ�м���������ڵ糡�������½��븺�����������������������˸��������ӱ��赲���ܽ����м���ң��ʿ��Եõ�NaOH��H2SO4��Ʒ����B��ȷ��
C.������Ϊ����������������Ӧ���缫��ӦʽΪ��2H2O-4e-�TO2+4H+�����������ӣ���������ҺpH���ͣ������������ӷŵ磬��Һ��pH���ߣ���C����
D.�ɵ缫��Ӧ2H2O-4e-�TO2+4H+��֪��ת��1mol���ӿ�������0.25mol��������D����
��ѡB��


 ��ĩ��ϰ���ϵ�д�
��ĩ��ϰ���ϵ�д� ����ѧ�䵥Ԫ������ĩר����100��ϵ�д�
����ѧ�䵥Ԫ������ĩר����100��ϵ�д� �Ƹ�360�ȶ����ܾ�ϵ�д�
�Ƹ�360�ȶ����ܾ�ϵ�д� ���⿼����Ԫ���Ծ�ϵ�д�
���⿼����Ԫ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪʵ������ȡ��������������װ��ͼ�����й��ڸ�ʵ��������У�����ȷ����

A. �Թ�b�е������¶˹ܿڲ��ܽ���Һ���ԭ���Ƿ�ֹʵ������з�����������
B. ��a�Թ����ȼ���Ũ���ᣬȻ���ҡ���Թܱ����������Ҵ����ټӱ�����
C. ʵ��ʱ�����Թ�a��Ŀ���Ǽ�ʱ�����������������ӿ췴Ӧ����
D. �Թ�b��Na2CO3�������dz�ȥ��������������������������Ҵ�������������������Һ���ܽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ɫ��������������������Ϊ�������ϻ���Ҫ����ǣ� ��
A.������չС�ͻ������糧B.�����������ಢ������������
C.ʹ�������ɽ����ʳƷ��װ����D.�Ľ��������պ��豸���������������ŷ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2�֣�N2H4��һ�ָ�Ч���Ļ��ȼ�ϣ�0.25mol N2H4��g����ȫȼ�����ɵ�������̬ˮʱ���ų�133.5kJ�������������Ȼ�ѧ��������ȷ���ǣ�������
A.![]() N2H4��g��+
N2H4��g��+![]() O2��g��=
O2��g��=![]() N2��g��+H2O��l����H=+257kJmol��1
N2��g��+H2O��l����H=+257kJmol��1
B.N2H4��g��+O2��g��=N2��g��+2H2O��l����H=��133.5kJmol��1
C.N2H4��g��+O2��g��=N2��g��+2H2O��g����H=+534kJmol��1
D.N2H4��g��+O2��g��=N2��g��+2H2O��g����H=��534kJmol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����г��û�ѧ�����У�����ֱ�����ڻ����ķ�����ᴿ���ǣ� ��
A.��ͨ©��B.����ƿC.��Һ©��D.������ƿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ѧ��ӦA2(g)��B2(g)===2AB(g)�������仯��ͼ��ʾ���ж�������������ȷ����
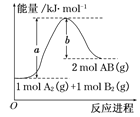
A. ÿ����2����AB����b kJ����
B. �÷�Ӧ����H����(a��b) kJ��mol��1
C. �÷�Ӧ�з�Ӧ��������������������������
D. ����1 mol A��A��1 mol B��B�����ų�a kJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҩ������ҽѧ��Խ��Խ�ܵ���ע����ҩҩ����˪����Ҫ�ɷ�As2O3�����������Ƽ���Ѫ����Ϊ�ˣ��鼰�仯�������ȡ�ٴ������ע��
��1��As��33��Ԫ�أ����������ڱ��е�λ����________________��
��2��NԪ�طǽ����Ա�Asǿ������˵����ȷ����_________________________��
��NH3�����ȶ��Ա�AsH3�� ��HNO3�����Ա�H3AsO4ǿ ��N��ԭ�Ӱ뾶��As��ԭ�Ӱ뾶С
��3��������ͼд��As2O5�ֽ�ΪAs2O3���Ȼ�ѧ����ʽ__________________��
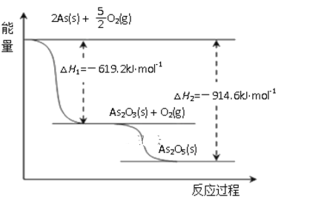
��4��������֪�����Դ����飨As2S3����������ȡAs2O3����ȡ�Ĺ������̼�ͼ���£�

��As2S3��Na3AsS3�е�S��Ϊ-2�ۣ���������з����ķ�Ӧ______����ǡ����ǡ���������ԭ��Ӧ��
�����̢��ϵ�в�������________________________________________________��
��д�����̢�����ӷ���ʽ__________________________________________________�����̢��У�����Խǿ��As2O3�IJ���Խ�ߣ��������ԭ��______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2 L�ܱ������ڣ�800 ��ʱNO(g)��O2(g)��Ӧ����NO2(g)����ϵ�У�n(NO)��ʱ��ı仯���±���ʾ��
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)������Ӧ________(��ǡ����ǡ�)���淴Ӧ���ڵ�5 sʱ��NO��ת����Ϊ________��

(2)��ͼ����ʾNO2�仯���ߵ���____����O2��ʾ��0��2 s�ڸ÷�Ӧ��ƽ������v��________��
(3)��ʹ�÷�Ӧ�ķ�Ӧ�����������________��
a����ʱ�����NO2����
b���ʵ������¶�
c������O2��Ũ��
d��ѡ���Ч�Ĵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ��� ����
A.�������Ż�ʱӦ����ĭ�������ʱ����
B.��������ķ�Һ����ˮ�ۣ���ˮ������ˮ��
C.ʵ���ҿ���ȼ�ŵľƾ���ȥ��ȼ��һֻ�ƾ���
D.ȡ�ý����ƺ�ʣ�����Ӧ�Ż�ԭ�Լ�ƿ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com