
【题目】下列说法正确的是( )
A.金属钠着火时应用泡沫灭火器及时扑灭
B.将含硫酸的废液倒入水槽,用水冲入下水道
C.实验室可用燃着的酒精灯去点燃另一只酒精灯
D.取用金属钠后剩余的钠应放回原试剂瓶
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是( )

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液碱性增强
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 阴极区溶液pH降低,阳极区溶液pH升高
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)→CO(g)+H2(g)在10L密闭容器中进行,1分钟后,水蒸气的物质的量减少了0.45mol,关于此反应的说法正确的是
A. 用水蒸气表示的速率为0.45mol/(Lmin)
B. 用氢气表示的速率为0.00075mol/(Ls)
C. 缩小容器体积将减慢反应速率
D. 加入更多的焦炭能加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温时向2 L密闭容器中通入一定量的气体X和Y,发生反应:2X(g)+Y(g)![]() 3Z(g) ΔH<0。Y的物质的量n(Y)随时间t变化的曲线如图所示。下列说法正确的是
3Z(g) ΔH<0。Y的物质的量n(Y)随时间t变化的曲线如图所示。下列说法正确的是

A. 该反应为吸热反应
B. 0~5min内,以X表示的化学反应速率是0.02 mol·L-1·min-1
C. b点时该反应达到了最大限度,反应停止
D. t0min时,c(Z)=0.75 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族.
(1)D在周期表中的位置______;B的原子结构示意图______;
(2)E元素形成最高价氧化物对应的水化物的化学式为______;
(3)元素C、D、E形成的原子半径大小关系是______(用元素符号表示).
(4)C、D可形成化合物D2C2,D2C2含有的化学键是______;
(5)A、C两种元素形成的原子个数之比为1:1的化合物电子式______,
(6)B的氢化物与B的最高价氧化物的水化物反应的离子方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质分类的说法正确的是
A. CO2能与碱反应生成盐和水,属于酸性氧化物
B. NaHSO4溶于水电离出H+,属于酸
C. NH4Cl组成中不含金属离子,不属于盐类
D. SO2溶于水形成的溶液能够导电,SO2是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的气态氢化物具有相同的电子数,一般情况下X的单质只有氧化性:
(1)写出实验室制取W2反应的离子方程式:________________________。
(2)某小组设计如图所示的实验装置(图中夹持和加热装置略去),分别研究YX2、W2的性质。
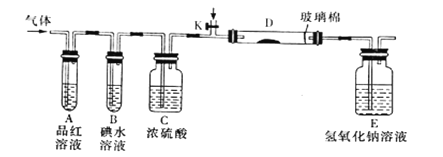
①分别通入YX2和W2,在装置A中观察到的现象是否相同_________________(填“相同”、“不相同”);若装置D中装的是铁粉,当通入W2时D中观察到的现象为__________;若装置D中装的是五氧化二钒,当通入YX2时,打开K通入适量X2,化学方程式为_______________________________________。
②若装置B中装入5.0mL1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,则该反应的化学方程式为__________________。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量_____(填字母)可以看到白色沉淀生成。
A.氨水 B.稀盐酸 C.稀硝酸 D.氯化钙
(4)如由元素Y和X组成-2价酸根Z,Z中Y和X的质量比为Y:X=4:3,当W2与含Z的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入足量氯化钡溶液,有白色沉淀产生,且两种沉淀物质量相等。写出W2与Z的溶液完全反应产生浅黄色沉淀的离子方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H= -746.4 kJ·mol-1。起始反应时 NO和CO各为 4 mol,10 秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是( )
N2(g)+2CO2(g) △H= -746.4 kJ·mol-1。起始反应时 NO和CO各为 4 mol,10 秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是( )
A. 反应前5秒钟内,用NO表示的平均反应速率为0.lmol·L-1·s-1
B. 达到平衡后,升髙温度,正反应速率将减小,逆反应速率将增大
C. 达到平衡后,反应速率的关系有:V正(CO)=2v逆(N2)
D. 保持容器体积不变,往容器中充入1 mol O2,正、逆反应速率都不改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com