
【题目】在2 L密闭容器内,800 ℃时NO(g)和O2(g)反应生成NO2(g)的体系中,n(NO)随时间的变化如下表所示:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应,在第5 s时,NO的转化率为________。

(2)如图,表示NO2变化曲线的是____,用O2表示从0~2 s内该反应的平均速率v=________。
(3)能使该反应的反应速率增大的是________。
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效的催化剂
【答案】是 65% b 0.001 5 mol·L-1·s-1 bcd
【解析】
(1)该反应是可逆反应,5s时反应达到平衡,依据转化率公式计算;
(2)由方程式2NO(g)+O2(g) ![]() 2NO2(g)知,NO2为生成物,初始状态时,c(NO2)=0,随反应的进行,c(NO2)逐渐增大,当达到平衡时保持不变;由速率公式和反应速率之比等于化学计量数之比计算;
2NO2(g)知,NO2为生成物,初始状态时,c(NO2)=0,随反应的进行,c(NO2)逐渐增大,当达到平衡时保持不变;由速率公式和反应速率之比等于化学计量数之比计算;
(3)由影响反应速率的因素分析。
(1)该反应是可逆反应,5s时,NO转化率为(0.020-0.007)mol/0.020mol×100%=65%,故答案为:是;65%;
(2)由方程式2NO(g)+O2(g) ![]() 2NO2(g)知,NO2为生成物,初始状态时,c(NO2)=0,随反应的进行,c(NO2)逐渐增大,当达到平衡时,c(NO2)=(0.020-0.007)mol/2L=0.0065mol/L,故表示NO2变化曲线的为b;0~2s内v(NO)=[(0.020-0.008)mol/2L]/2s=0.003 mol·L-1·s-1,由反应速率之比等于化学计量数之比可得v(O2)= 0.001 5 mol·L-1·s-1,故答案为:b;0.001 5 mol·L-1·s-1;
2NO2(g)知,NO2为生成物,初始状态时,c(NO2)=0,随反应的进行,c(NO2)逐渐增大,当达到平衡时,c(NO2)=(0.020-0.007)mol/2L=0.0065mol/L,故表示NO2变化曲线的为b;0~2s内v(NO)=[(0.020-0.008)mol/2L]/2s=0.003 mol·L-1·s-1,由反应速率之比等于化学计量数之比可得v(O2)= 0.001 5 mol·L-1·s-1,故答案为:b;0.001 5 mol·L-1·s-1;
(3)及时分离出NO2气体,反应速率减慢,a错误;
适当升高温度,反应速率加快,b正确;
增大O2的浓度,反应物浓度增大,反应速率加快,c正确;
选择高效的催化剂,反应速率加快,d正确;
故选bcd,故答案为:bcd。


科目:高中化学 来源: 题型:
【题目】某同学购买了一瓶“84消毒液”,包装说明如下,请根据以上信息和相关知识判断,下列分析不正确的是

A. 该“84消毒液”的物质的量浓度约为4.0 mol·L-1
B. 一瓶该“84消毒液”敞口放置一段时间后浓度会变小
C. 取100 mL该“84消毒液”稀释100倍,稀释后溶液中c(Na+)约为0.04mol·L-1
D. 参阅该“84消毒液”的配方,欲用NaClO固体配制含25%NaClO的消毒液480mL,需要称量的NaClO固体质量为143g
查看答案和解析>>
科目:高中化学 来源: 题型:
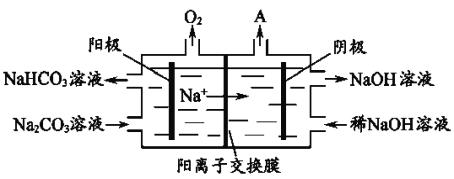
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是( )

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液碱性增强
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 阴极区溶液pH降低,阳极区溶液pH升高
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。
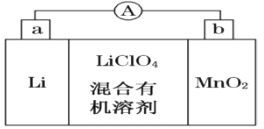
回答下列问题:
(1)外电路的电流方向是由______极流向______极。(填字母)
(2)电池正极反应式为 _____________________。
(3)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为 _________________。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为__________。
(4)电解Na2CO3溶液,原理如图所示。
阳极的电极反应式为__________________,阴极产生的物质A的化学式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的位置如图所示。下列说法正确的是

A. W元素原子得电子能力比Z的弱
B. 元素W的最高价氧化物对应的水化物是强酸
C. 元素Y的原子半径在同周期主族元素中最大
D. 元素Z的气态氢化物的稳定性在同主族元素中最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关从海带中提取碘的实验原理和装置能达到实验目的的是

A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I的Cl2
D. 用装置丁吸收氧化浸泡液中I后的Cl2尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)→CO(g)+H2(g)在10L密闭容器中进行,1分钟后,水蒸气的物质的量减少了0.45mol,关于此反应的说法正确的是
A. 用水蒸气表示的速率为0.45mol/(Lmin)
B. 用氢气表示的速率为0.00075mol/(Ls)
C. 缩小容器体积将减慢反应速率
D. 加入更多的焦炭能加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温时向2 L密闭容器中通入一定量的气体X和Y,发生反应:2X(g)+Y(g)![]() 3Z(g) ΔH<0。Y的物质的量n(Y)随时间t变化的曲线如图所示。下列说法正确的是
3Z(g) ΔH<0。Y的物质的量n(Y)随时间t变化的曲线如图所示。下列说法正确的是

A. 该反应为吸热反应
B. 0~5min内,以X表示的化学反应速率是0.02 mol·L-1·min-1
C. b点时该反应达到了最大限度,反应停止
D. t0min时,c(Z)=0.75 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的气态氢化物具有相同的电子数,一般情况下X的单质只有氧化性:
(1)写出实验室制取W2反应的离子方程式:________________________。
(2)某小组设计如图所示的实验装置(图中夹持和加热装置略去),分别研究YX2、W2的性质。
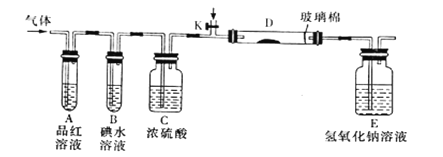
①分别通入YX2和W2,在装置A中观察到的现象是否相同_________________(填“相同”、“不相同”);若装置D中装的是铁粉,当通入W2时D中观察到的现象为__________;若装置D中装的是五氧化二钒,当通入YX2时,打开K通入适量X2,化学方程式为_______________________________________。
②若装置B中装入5.0mL1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,则该反应的化学方程式为__________________。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量_____(填字母)可以看到白色沉淀生成。
A.氨水 B.稀盐酸 C.稀硝酸 D.氯化钙
(4)如由元素Y和X组成-2价酸根Z,Z中Y和X的质量比为Y:X=4:3,当W2与含Z的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入足量氯化钡溶液,有白色沉淀产生,且两种沉淀物质量相等。写出W2与Z的溶液完全反应产生浅黄色沉淀的离子方程式_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com