
����Ŀ��ijͬѧ������һƿ��84����Һ������װ˵�����£������������Ϣ�����֪ʶ�жϣ����з�������ȷ����

A. ����84����Һ�������ʵ���Ũ��ԼΪ4.0 mol��L��1
B. һƿ����84����Һ�����ڷ���һ��ʱ���Ũ�Ȼ��С
C. ȡ100 mL����84����Һ��ϡ��100����ϡ�ͺ���Һ��c(Na��)ԼΪ0.04mol��L��1
D. ���ĸ���84����Һ�����䷽������NaClO�������ƺ�25%NaClO������Һ480mL����Ҫ������NaClO��������Ϊ143g
���𰸡�D
��������
A������84����Һ�������ʵ���Ũ��Ϊ��c��NaClO��=![]() mol/L��4.0mol/L����A��ȷ��B��HClO�ֽ������Ȼ������������һƿ����84����Һ�����ڷ���һ��ʱ���Ũ�Ȼ��С����B��ȷ��C��ȡ100mL����84����Һ��ϡ��100��������������ϡ�����������ӵ����ʵ������䣬��ϡ�ͺ����Һ��c��Na+��=
mol/L��4.0mol/L����A��ȷ��B��HClO�ֽ������Ȼ������������һƿ����84����Һ�����ڷ���һ��ʱ���Ũ�Ȼ��С����B��ȷ��C��ȡ100mL����84����Һ��ϡ��100��������������ϡ�����������ӵ����ʵ������䣬��ϡ�ͺ����Һ��c��Na+��=![]() =0.04molL-1����C��ȷ��D��ʵ���Ҳ�����480mL����ƿ��Ӧ��500mL����ƿ���ƣ���n��NaClO��=0.5L��4.0mol/L=2.0mol��m��NaClO��=2.0mol��74.5g/mol=149g����D����ѡD��
=0.04molL-1����C��ȷ��D��ʵ���Ҳ�����480mL����ƿ��Ӧ��500mL����ƿ���ƣ���n��NaClO��=0.5L��4.0mol/L=2.0mol��m��NaClO��=2.0mol��74.5g/mol=149g����D����ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4 mol A�����2 mol B������2 L�������л�ϲ���һ�������·������·�Ӧ��2A(g)+B(g)![]() 2C(g)������2 s����C��Ũ��Ϊ0.6 mol��L-1���������м���˵����
2C(g)������2 s����C��Ũ��Ϊ0.6 mol��L-1���������м���˵����
��������A��ʾ�ķ�Ӧƽ������Ϊ0.6 mol��L-1��s-1
��������B��ʾ�ķ�Ӧ��ƽ������Ϊ0.15mol��L-1��s-1
��2sʱ����A��ת����Ϊ30%
��2sʱ����B��Ũ��Ϊ0.3 mol��L-1
������ȷ����
A. �٢� B. �٢� C. �ڢ� D. �ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪʵ������ȡ��������������װ��ͼ�����й��ڸ�ʵ��������У�����ȷ����

A. �Թ�b�е������¶˹ܿڲ��ܽ���Һ���ԭ���Ƿ�ֹʵ������з�����������
B. ��a�Թ����ȼ���Ũ���ᣬȻ���ҡ���Թܱ����������Ҵ����ټӱ�����
C. ʵ��ʱ�����Թ�a��Ŀ���Ǽ�ʱ�����������������ӿ췴Ӧ����
D. �Թ�b��Na2CO3�������dz�ȥ��������������������������Ҵ�������������������Һ���ܽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��г��ˢ١�������Ԫ�������ڱ��е�λ�ã�
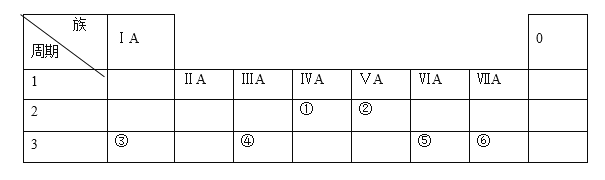
�밴Ҫ��ش��������⡣
(1)Ԫ�آٵ�Ԫ�ط�����________�� Ԫ�آڵĵ��ʵ���ʽ��_______��Ԫ�آݵ�ԭ�ӽṹʾ��ͼ��_______��
(2)�ۺ͢��γɵĻ�������������ѧ������_______��
(3)HF�е�Ȣ��⻯��ķе�_____����ͣ���ԭ����________��
(4)������Ԫ���У�λ�ڵ���������ԭ�Ӱ뾶��С����(��Ԫ�ط���)________��
(5)������Ԫ�ص�����������У����������������Ԫ����(��Ԫ�ط���)___________��
(6)��ʢ��ˮ��С�ձ��м���Ԫ�آ۵ĵ��ʣ�������Ӧ�����ӷ���ʽΪ_________________����������Ӧ�����Һ���ټ���Ԫ�آܵĵ��ʣ�������Ӧ�Ļ�ѧ����ʽΪ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Բ��ϲ�ҵ��21���������չ�ĸ߿Ƽ�֧����ҵ֮һ����Ϊ��Ϣ��ҵ�ͻ��繤ҵ����Ҫ�������ܲ��ϣ����Բ��Ϲ㷺���ڵ�����Ϣ�����¼���������̼������Ҫ�����Ʊ����������壬��ҵ�������̿�(��Ҫ�ɷ�ΪMnO2)�ͻ�����(��Ҫ�ɷ�ΪFeS2)Ϊ��Ҫԭ���Ʊ�̼���̵���Ҫ�����������£�

��֪�����ֽ������ӳ�����pH���±���
Fe2�� | Fe3�� | Cu2�� | Mn2�� | |
��ʼ������pH | 7.5 | 3.2 | 5.2 | 8.8 |
��ȫ������pH | 9.2 | 3.7 | 7.8 | 10. 4 |
�ش��������⣺
��1��Ϊ������ܽ�������ԭ�ϵĽ���Ч�ʣ���ȡ�Ĵ�ʩ����������________��
A������ B���ʵ������¶� C����ĥ��ʯ D����������������ˮ
��2���ܽ���������Ҫ�����Ľ���������ΪFe3����Mn2������ȡ�����Һ�к�������Fe2����Cu2����Ca2�������ڼ���ʯ�ҵ�����Һ��pH�Ӷ�ʹ��Ԫ�ر���ȫ����ǰ���������������̿��䷢����Ӧ�����ӷ���ʽΪ____________________������ʯ�ҵ�����ҺpH�ķ�ΧΪ____________________��
��3�����������Ŀ���dz�ȥ��Һ�е�Cu2����Ca2�������ʣ���������Ҫ��________(�ѧʽ)��CaF2���������Һ��c(F��)Ϊ0.01mol��L��1������Һ�в���c(Ca2��)Ϊ________mol��L��1[��֪��Ksp(CaF2)��1.46��10��10]��
��4��������Ϊ����������ʹ��NaF��������Ⱦ��������(NH4)2CO3����NaF��������(NH4)2CO3����NaF��ȱ����______________________________________��
��5����ͼΪ������������������̽����ʵ�Ӱ�죬����ͼ����Ϣ�����������������Ӧ������________�����ҡ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Ҫ�Ļ���ԭ�ϣ���ҵ����N2��H2�ϳ�NH3���ּ�֪N2(g)��H2(g)��Ӧ����1 molNH3(g)�����������仯ʾ��ͼ����ͼ����N-H������Ϊ
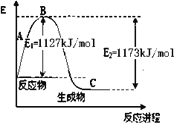
��ѧ�� | H-H | N��N |
���ܣ�kJ/mol�� | 436 | 946 |
A. 248kJ/molB. 391kJ/molC. 862kJ/molD. 431kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ɫ��������������������Ϊ�������ϻ���Ҫ����ǣ� ��
A.������չС�ͻ������糧B.�����������ಢ������������
C.ʹ�������ɽ����ʳƷ��װ����D.�Ľ��������պ��豸���������������ŷ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2�֣�N2H4��һ�ָ�Ч���Ļ��ȼ�ϣ�0.25mol N2H4��g����ȫȼ�����ɵ�������̬ˮʱ���ų�133.5kJ�������������Ȼ�ѧ��������ȷ���ǣ�������
A.![]() N2H4��g��+
N2H4��g��+![]() O2��g��=
O2��g��=![]() N2��g��+H2O��l����H=+257kJmol��1
N2��g��+H2O��l����H=+257kJmol��1
B.N2H4��g��+O2��g��=N2��g��+2H2O��l����H=��133.5kJmol��1
C.N2H4��g��+O2��g��=N2��g��+2H2O��g����H=+534kJmol��1
D.N2H4��g��+O2��g��=N2��g��+2H2O��g����H=��534kJmol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2 L�ܱ������ڣ�800 ��ʱNO(g)��O2(g)��Ӧ����NO2(g)����ϵ�У�n(NO)��ʱ��ı仯���±���ʾ��
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)������Ӧ________(��ǡ����ǡ�)���淴Ӧ���ڵ�5 sʱ��NO��ת����Ϊ________��

(2)��ͼ����ʾNO2�仯���ߵ���____����O2��ʾ��0��2 s�ڸ÷�Ӧ��ƽ������v��________��
(3)��ʹ�÷�Ӧ�ķ�Ӧ�����������________��
a����ʱ�����NO2����
b���ʵ������¶�
c������O2��Ũ��
d��ѡ���Ч�Ĵ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com