
【题目】锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。
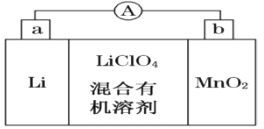
回答下列问题:
(1)外电路的电流方向是由______极流向______极。(填字母)
(2)电池正极反应式为 _____________________。
(3)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为 _________________。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为__________。
(4)电解Na2CO3溶液,原理如图所示。
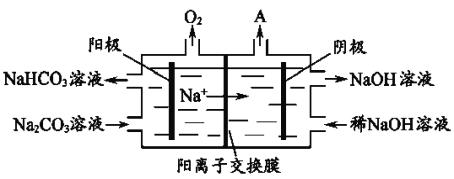
阳极的电极反应式为__________________,阴极产生的物质A的化学式为____________。
【答案】b a MnO2+e-+Li+=LiMnO2 3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O 2∶1 2H2O-4e-+4CO32-=4HCO3-+O2 H2
3K2MnO4+KCl+3H2O 2∶1 2H2O-4e-+4CO32-=4HCO3-+O2 H2
【解析】
形成原电池反应时,Li为负极,被氧化,电极方程式为Li-e-=Li+,MnO2为正极,被还原,电极方程式为MnO2+e-+Li+=LiMnO2,结合电极方程式以及元素化合价的变化解答。
(1)Li为负极,MnO2为正极,原电池工作时,外电路的电流方向从正极到负极,即从b极流向a极,故答案为:b;a;
(2)MnO2为正极,被还原,电极方程式为MnO2+e-+Li+=LiMnO2,故答案为:MnO2+e-+Li+=LiMnO2.
(3)二氧化锰与KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,反应中化合价变化的元素为Mn、Cl,Mn元素由+4价升高为+6,Cl元素化合价由+5降低为-1,根据化合价升降相等,则二氧化锰与氯酸钾的物质的量之比为3∶1,再根据原子守恒配平方程式为:3MnO2+6KOH+KClO3![]() 3K2MnO4+KCl+3H2O;
3K2MnO4+KCl+3H2O;
K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2,反应中Mn元素化合价分别由+6价升高到7价、降低到+4价,由氧化还原反应氧化剂和还原剂之间得失电子数目相等可知,生成KMnO4和MnO2的物质的量之比为2∶1,故答案为:3MnO2+6KOH+KClO3 ![]() 3K2MnO4+KCl+3H2O;2∶1;
3K2MnO4+KCl+3H2O;2∶1;
(4)由图可知,阳极反应为4CO32-+2H2O-4e-═4HCO3-+O2↑,阴极上氢离子得到电子生成氢气,则阴极产生的物质A的化学式为H2,故答案为:4CO32-+2H2O-4e-═4HCO3-+O2↑;H2。


科目:高中化学 来源: 题型:
【题目】下表列出了①~⑥六种元素在周期表中的位置:
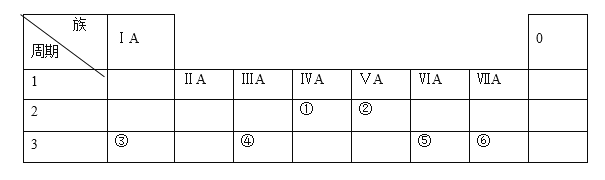
请按要求回答下列问题。
(1)元素①的元素符号是________。 元素②的单质电子式是_______。元素⑤的原子结构示意图是_______。
(2)③和⑥形成的化合物中所含化学键类型_______。
(3)HF沸点比⑥氢化物的沸点_____(高或低),原因是________。
(4)这六种元素中,位于第三周期且原子半径最小的是(填元素符号)________。
(5)这六种元素的最高价氧化物中,属于两性氧化物的元素是(填元素符号)___________。
(6)在盛有水的小烧杯中加入元素③的单质,发生反应的离子方程式为_________________。向上述反应后的溶液中再加入元素④的单质,发生反应的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2分)N2H4是一种高效清洁的火箭燃料.0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量.则下列热化学方程中正确的是( )
A.![]() N2H4(g)+
N2H4(g)+![]() O2(g)=
O2(g)=![]() N2(g)+H2O(l)△H=+257kJmol﹣1
N2(g)+H2O(l)△H=+257kJmol﹣1
B.N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=﹣133.5kJmol﹣1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=+534kJmol﹣1
D.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣534kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,判断下列叙述中正确的是
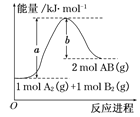
A. 每生成2分子AB吸收b kJ热量
B. 该反应热ΔH=+(a-b) kJ·mol-1
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1 mol A—A和1 mol B—B键,放出a kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药在世界医学界越来越受到关注。中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注。
(1)As是33号元素,则其在周期表中的位置是________________。
(2)N元素非金属性比As强,下列说法正确的是_________________________。
①NH3的热稳定性比AsH3差 ②HNO3的酸性比H3AsO4强 ③N的原子半径比As的原子半径小
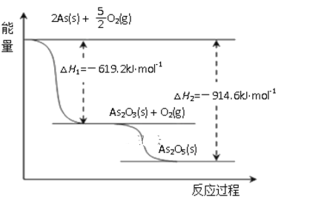
(3)根据下图写出As2O5分解为As2O3的热化学方程式__________________。
(4)查文献得知,可以从硫化砷(As2S3)废渣中提取As2O3,提取的工艺流程简图如下:

①As2S3、Na3AsS3中的S均为-2价,碱浸过程中发生的反应______(填“是”或“不是”)氧化还原反应。
②过程Ⅲ的系列操作包括________________________________________________。
③写出过程Ⅲ的离子方程式__________________________________________________,过程Ⅲ中,酸性越强,As2O3的产率越高,请解释其原因______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器内,800 ℃时NO(g)和O2(g)反应生成NO2(g)的体系中,n(NO)随时间的变化如下表所示:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应,在第5 s时,NO的转化率为________。

(2)如图,表示NO2变化曲线的是____,用O2表示从0~2 s内该反应的平均速率v=________。
(3)能使该反应的反应速率增大的是________。
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质性质与应用对应关系正确的是( )
A.次氯酸有酸性,可用于漂白、杀菌消毒
B.二氧化硫具有漂白性,可用于粉丝、木耳等的漂白
C.液氨汽化时要吸收大量的热,工业上可用作制冷剂
D.晶体硅的熔点高、硬度大,可用于制作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1L含0.01molNaAlO2和0.02molNaOH的溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,当0.01mol<n(CO2) ![]() 0.015时发生的反应是:2 NaAlO2+ CO2+2H2O=2Al(OH)3↓+Na2CO3下列对应关系正确的是( )
0.015时发生的反应是:2 NaAlO2+ CO2+2H2O=2Al(OH)3↓+Na2CO3下列对应关系正确的是( )
选项 | n(CO2)/mol | 溶液中离子的物质的量浓度 |
A | 0 | c(Na+)>c(AlO2-)+c(OH-) |
B | 0.01 | c(Na+)>c(AlO2-)> c(OH-)>c(CO32-) |
C | 0.015 | c(Na+)> c(HCO3-)>c(CO32-)> c(OH-) |
D | 0.03 | c(Na+)> c(HCO3-)> c(OH-)>c(H+) |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com