
【题目】A、B、C、D均为四种短周期元素,它们的原子序数依次增大。A与其他几种元素均不在同一周期;B元素最高价氧化物对应的水化物能与其最简单氢化物反应生成一种盐X;C能形成两种常温下为液态的氢化物;D与C同主族。则下列说法中不正确的是( )
A.原子半径大小关系:A<C<B
B.在0.1molL-1的X溶液中,溶液中阳离子的数目小于0.1NA
C.C、D两种元素分别与A形成的最简单化合物的沸点C比D的要高
D.化合物X受热易分解
【答案】B
【解析】
A与其他几种元素均不在同一周期,且原子序数最小,可推知A为H, B元素最高价氧化物对应的水化物能与其最简单氢化物反应生成一种盐X ,指的是HNO3与NH3反应生成NH4NO3,C能形成两种常温下为液态的氢化物H2O和H2O2,A、B、C、D均为四种短周期元素分别为H、N、O、S。
A.原子半径大小关系:H<O<N ,A正确;
B.在0.1molL-1的NH4NO3溶液中,NH4++H2O![]() NH3H20+H+ ,溶液中阳离子的数目应等于0.1NA,B 错误;
NH3H20+H+ ,溶液中阳离子的数目应等于0.1NA,B 错误;
C. C、D两种元素分别与A形成的最简单化合物H2O和H2S,常温下H2O分子为液态,而H2S为气态,沸点H2O比H2S的要高,C正确;
D.化合物NH4NO3为氨盐,不稳定,受热易分解,D正确;
故本题选B。


科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液中粒子浓度关系正确的是( )
A.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-)
B.pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-)
C.常温下,0.1molL-1的①NH4Cl②CH3COONH4③NH4HSO4溶液中:c(NH4+)大小顺序:①>②>③
D.物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,1mol/L的HA和1mol/L的HB两种酸溶液,起始时的体积均为V0,分别向两溶液中加水进行稀释,所得变化关系如图所示(V表示溶液稀释后的体积)。下列说法错误的是
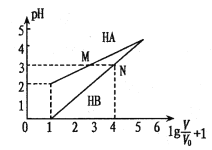
A. Ka( HA)约为10-4
B. 当两溶液均稀释至![]() 时,溶液中
时,溶液中![]() >
>![]()
C. 中和等体积pH相同的两种酸所用n(NaOH):HA>HB
D. 等体积、等物质的量浓度的NaA和NaB溶液中离子总数前者小于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】薄荷油中含有少量![]() —非兰烃,其相对分子质量为136。根据如下转化,回答相关问题。
—非兰烃,其相对分子质量为136。根据如下转化,回答相关问题。

已知:a.![]()
b.![]()
c.2CH3COOH![]()
(1)![]() —非兰烃的结构简式为_________________。
—非兰烃的结构简式为_________________。
(2)B中含有的官能团名称为__________,C→D的反应类型为________________。
(3)C→H的反应方程式为_________________________________。
(4)写出符合下列条件A的同分异构体__________(写三种即可)。
①含有4个—CH3②1mol此同分异构体在碱性条件下水解需2mol NaOH。
(5)以 为原料合成
为原料合成 。_____________(用流程图表示,其他无机试剂任选)
。_____________(用流程图表示,其他无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石棉尾矿主要含有Mg3(Si2O5)(OH)和少量的Fe2O3、Al2O3。以石棉尾矿为镁源制备碳酸镁晶体(MgCO3·nH2O)的工艺如图:

已知“焙烧”过程中的主反应为:Mg3(Si2O5)(OH)4+5(NH4)2SO4![]() 3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑
3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑
(1)写出焙烧产物NH3的电子式__。
(2)为提高水浸速率,可采取的措施为__(任写一条即可),“浸渣”的主要成分为___。
(3)①“调节pH除杂”时,除去的杂质离子是__,室温下,若要将溶液中的c(Fe3+)降低至4.0×10-11mol/L,则应控制溶液的pH=___(Ksp[Fe(OH)3]=4.0×10-38)。
②“调节pH除杂”时,可以选用的试剂是___。
A.MgO B.NaOH C.MgCO3 D.HNO3
(4)“沉镁”过程中反应的离子方程式为___。“沉镁”时若温度超过60℃,将产生较多的碱式碳酸镁[Mg2(OH)2CO3]杂质,原因是__。
(5)某小组同学称取15.6gMgCO3·nH2O进行热重分析,并绘制剩余固体质量随温度变化的曲线如图所示,则n=__。
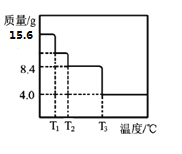
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,属于同分异构体的是( )
A.![]() 和
和![]()
B.H2N-CH2-COOH 和 H3C-CH2-NO2
C.CH3-CH2-CH2-COOH 和 H3C-CH2-CH2-CH2-COOH
D.H3C-CH2-O-CH2-CH3 和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型储氢材料是开发利用氢能的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Cl原子中,电子占据的最高电子层符号为__,该电子层具有的原子轨道数为__。
②LiBH4由Li+和BH4-构成,BH4-的立体构型是__,B原子的杂化轨道类型是___。
③Li、B元素的电负性由小到大的顺序为___。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+__H-(填“>”“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
I1/kJ·mol-1 | I2/kJ·mol-1 | I3/kJ·mol-1 | I4/kJ·mol-1 | I5/kJ·mol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是__族元素。
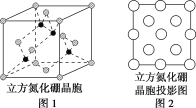
(3)图2是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和涂“![]() ”分别标明B与N的相对位置___。
”分别标明B与N的相对位置___。
(4)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm,Na+半径为102pm,H-的半径为__,NaH的理论密度是__g·cm-3(保留3个有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(环境污染与资源短缺问题日益突出,资源的循环利用尤为重要。工业 上利用含 Cu2O(含少量 Al2O3、Fe2O3 和 SiO2)的矿渣提取铜的工艺流程如下:
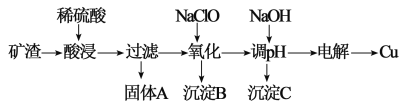
已知:①Cu2O 在酸性条件下易转化成单质 Cu 和含 Cu2+的溶液;
②几种氢氧化物沉淀时的 pH 如下表:
氢氧化物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 |
沉淀时的 pH | 4.0~5.2 | 5.8~8.8 | 1.1~3.2 | 5.4~6.7 |
回答下列问题:
(1)经检测固体 A 含有的成分为 Cu 和另一种杂质,从固体 A 中分离出 Cu 的可 用试剂为_____溶液(填化学式)。
(2)矿渣经酸浸、过滤、洗涤后铁元素的主要存在形式为__________填离子符号),检验该离子的常用化学试剂是_________________。
(3)加 NaClO 氧化并调整溶液的 pH 为_____,得到沉淀 B 和一种具有漂白 性的物质 D,该反应离子方程式为_________。
(4)25℃时,加 NaOH 固体调节溶液 pH 得到 Al(OH)3 沉淀,若 pH=5.3 时,所得 溶液中 c(Al3+)=_____。已知 25℃时 Ksp[Al(OH)3]=1.3×10-33。
(5)用惰性电极电解获得金属铜时,起始阶段阳极产物与阴极产物的物质的量之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.铅蓄电池在放电过程中,负极、正极质量都增加
B.常温下,反应![]() 不能自发进行,则该反应的
不能自发进行,则该反应的![]()
C.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
D.相同条件下,溶液中![]() 、
、![]() 、
、![]() 的氧化性依次减弱
的氧化性依次减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com