
【题目】电解锰工艺过程会产生锰、镁复盐,其组成为(NH4)7MnMg2(SO4)6.521H2O。一种综合利用该复盐的工艺流程如图所示:

已知:Ksp[Mg(OH)2]=1.8×10-11,Kb(NH3H2O)=1.8×10-5。回答下列问题:
(1)(NH4)7MnMg2(SO4)6.521H2O的水溶液呈__________________性(填“酸”或“碱”) ,Mn的化合价为__________________。
(2)“沉锰”的离子反应方程式为__________________;滤液1溶质的主要成分有__________________。
(3)“沉锰”过程中pH和温度对Mn2+和Mg2+沉淀率的影响如图所示:

①由图可知,“沉锰”合适的条件为__________________。
②Mg2+主要生成的是__________________沉淀(填“Mg(OH)2”或“MgCO3”),当温度高于45℃时Mg2+和Mn2+沉淀率的变化如图所示,原因是__________________。
(4)若将NH3通入0.01molL-1MgSO4溶液至Mg2+完全沉淀,则此时溶液中NH3H2O的物质的量浓度为__________________。(已知![]() =1.34,忽略反应前后溶液体积的变化,计算结果保留两位有效数字)
=1.34,忽略反应前后溶液体积的变化,计算结果保留两位有效数字)
【答案】酸 +2 HCO3-+NH3H2O+Mn2+=MnCO3↓+NH4++H2O (NH4)2SO4、MgSO4 pH=7.5、45℃ Mg(OH)2 当温度高于45℃,随着温度升高,NH4HCO3分解,c(CO32-)下降,所以Mn2+沉淀率下降,同时,随着温度升高,Mg2+水解生成Mg(OH)2程度增大,所以Mg2+沉淀率增大 ![]() molL-1≈1.5molL-1
molL-1≈1.5molL-1
【解析】
(NH4)7MnMg2(SO4)6.521H2O经溶解加热后,分解后逸出,加入氨水和碳酸氢铵将锰离子转化为碳酸锰沉淀,过滤后,得到滤液1 ,主要成分为(NH4)2SO4、MgSO4,加入氨水后得到沉淀氢氧化镁和滤液2 为(NH4)2SO4,碳酸锰沉淀加入硫酸后,得到硫酸锰。
(1)由于(NH4)7MnMg2(SO4)6.521H2O属于强酸弱碱盐,水溶液呈酸性,根据所有化合价之和等于0,设Mn的化合价为x,(+1)×7+x+(+2)×2+(-2)×6.5=0,计算出Mn的化合价为+2;
(2)“沉锰”是将锰离子转化为碳酸锰沉淀,离子反应方程式为HCO3-+NH3H2O+Mn2+=MnCO3↓+NH4++H2O;复盐溶液经沉锰后过滤得到的滤液1溶质的主要成分有(NH4)2SO4、MgSO4;
(3)①“沉锰”是为了让锰离子最大可能的沉淀,让镁离子不要沉淀,可以选择pH=7.5、45℃,这时锰离子的沉淀量最大,镁离子的沉淀量最小;
②Mg2+在碱性条件生成Mg(OH)2沉淀,当温度高于45℃,随着温度升高,NH4HCO3分解,c(CO32-)下降,所以Mn2+沉淀率下降;同时,随着温度升高,Mg2+水解生成Mg(OH)2程度增大.所以Mg2+沉淀率增大;
(4)Ksp[Mg(OH)2]=1.8×10-11, Ksp=c(Mg2+)c2(OH-),![]() (molL-1)2,由于2c (SO42-)= c (NH4+),0.01molL-1MgSO4溶液中,c(SO42-)=0.01molL-1, c(NH4+)=0.02molL-1,
(molL-1)2,由于2c (SO42-)= c (NH4+),0.01molL-1MgSO4溶液中,c(SO42-)=0.01molL-1, c(NH4+)=0.02molL-1, ![]() ,Kb(NH3H2O)=1.8×10-5,
,Kb(NH3H2O)=1.8×10-5,![]() ,
,![]()
![]() molL-1≈1.5molL-1。
molL-1≈1.5molL-1。


科目:高中化学 来源: 题型:
【题目】肉桂酸是一种重要的化工原料,熔点为133 ℃、沸点为300 ℃,不溶于冷水,易溶于有机溶剂,广泛应用于医药、感光树脂和食品添加剂。实验室用苯甲醛和乙酸酐[化学式为(CH3CO)2O,有吸湿性,溶于水形成乙酸]制备肉桂酸的反应原理如下:
![]() +(CH3CO)2O
+(CH3CO)2O![]()
![]() +CH3COOH
+CH3COOH
过程中发生的副反应如下:
实验步骤如下:
步骤1:在三颈烧瓶中加入3 mL苯甲醛、8 mL乙酸酐和4.2 g K2CO3固体,搅拌,控制温度在150~170 ℃,加热回流45 min。
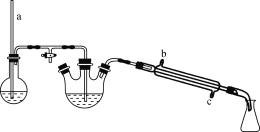
步骤2:向反应液中分批加入20 mL水,再加入Na2CO3固体调节溶液pH至8,然后进行水蒸气蒸馏。(装置如图)
步骤3:待三颈烧瓶中的剩余液体冷却后,加入活性炭,煮沸10~15 min,趁热过滤。
步骤4:将滤液冷却至室温,用盐酸酸化,待晶体析出完全后进行抽滤,用冷水洗涤晶体,干燥得到产品。
(1) 步骤1中,三颈烧瓶使用前必须干燥的原因是________;加入过量乙酸酐的目的是________。
(2) 步骤2中,水蒸气蒸馏时所用装置中玻璃管a的作用是________;冷凝管中冷凝水应从________(填“b”或“c”)口流入。
(3) 步骤3中,加入活性炭的目的是__________________________________。
(4) 步骤4中,抽滤所用的装置包括________、吸滤瓶和抽气泵。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图装置中X和Y均为石墨电极,电解液为500mL某CuCl2溶液,电解时X电极表面有红色固体生成,Y电极有气体产生。一段时间后,取出X电极,洗涤、干燥、称量,电极增重1.6g。下列有关说法中正确的是
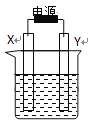
A. X电极连接电源正极
B. 生成气体体积为0.56L
C. Y电极上发生氧化反应
D. 该CuCl2溶液浓度为0.05mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列条件的溶液中,各组离子一定能够大量共存的是( )
A.使酚酞溶液变红的溶液:Na+、Cl-、SO42-、Fe3+
B.无色透明溶液中:K+、SO42-、MnO4-、H+
C.含有大量OH-的溶液中:Ba2+、Na+、NO3-、Cl-
D.可与锌反应放出氢气的溶液中:Na+、Ca2+、Cl-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验结论与实验操作及现象相符的一组是( )
选项 | 实验操作及现象 | 实验结论 |
A. | 向某溶液中加入HCl 溶液,产生的气体使澄清的石灰水变浑浊 | 该溶液中含有CO32- |
B. | 向某溶液中通入Cl2,再加入KSCN溶液,溶液变红 | 该溶液中一定含有Fe2+ |
C. | 铁粉加入CuSO4溶液中,析出红色固体 | 氧化性:Fe2+ > Cu2+ |
D. | 向FeCl3溶液中滴加浓的维生素C溶液,黄色褪去 | 维生素C具有还原性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)工业上利用N2和H2合成NH3,NH3又可以进一步制备联氨(N2H4)等。由NH3制备N2H4的常用方法是NaClO氧化法,其离子反应方程式为___________,有学者探究用电解法制备的效率,装置如图,试写出其阳极电极反应式_________;

(2)乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇(CH3CH2OH)的一种反应原理为:2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g) △H=-akJ/mol,己知:CO(g)+H2O(g)
CH3CH2OH(g)+H2O(g) △H=-akJ/mol,己知:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-bkJ/mol,以CO2(g)与H2(g)为原料也可合成气态乙醇,并放出热量,写出该反应的热化学反应方程式:_________________。
CO2(g)+H2(g) △H=-bkJ/mol,以CO2(g)与H2(g)为原料也可合成气态乙醇,并放出热量,写出该反应的热化学反应方程式:_________________。
(3)如下图所示,某研究性学习小组利用上述燃烧原理设计一个肼(N2H4)─空气燃料电池(如图甲)并探究某些工业原理,其中乙装置中X为阳离子交换膜(即只允许阳离子通过)。

根据要求回答相关问题:
①甲装置中正极的电极反应式为:________________。
②乙装置中石墨电极产生产物如何检验______,电解一段时间后,乙池中的溶液呈___性。
③图中用丙装置模拟工业中的________原理,如果电解后丙装置精铜质量增加3.2g,则理论上甲装置中肼消耗质量为_____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学方程式的说法正确的是
A. H2的燃烧热为285.8 kJ·mol1,则表示H2燃烧的热化学方程式可表示为:H2(g)+ ![]() O2
O2![]() H2O(g) ΔH=285.8 kJ·mol1
H2O(g) ΔH=285.8 kJ·mol1
B. 中和热为57.3 kJ·mol1,则NaOH与醋酸反应的中和热可以表示如下:NaOH(aq)+CH3COOH(aq)![]() CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
C. 已知:C(s,金刚石)+O2(g)![]() CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)
CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)![]() CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)
CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)![]() C(s,石墨)ΔH=1.9 kJ·mol1
C(s,石墨)ΔH=1.9 kJ·mol1
D. 已知1 mol CH4完全燃烧生成CO2和液态水放出890.4 kJ的热量,则该反应中转移1 mol电子时放出的热量为222.6 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 mol的镁、铝混合物溶于100 mL 2 mol/L H2SO4溶液中,然后再滴加1 mol/L NaOH溶液。图中横坐标表示加入NaOH溶液的体积,纵坐标表示生成沉淀的质量,有关说法正确的是( )
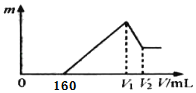
A.V1=400
B.金属粉末中含铝1.35 g
C.最后剩余沉淀质量5.8 g
D.无法确定V2的数值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气的主要组分为CO和H2;以天然气为原料生产的合成气有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g)2CO(g)+2H2(g)。在特定温度下,向甲、乙、丙三个密闭容器中充入相同量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如下表所示:
实验编号 | 容器温度/℃ | 容器体积 | 物质浓度/(mol·L-1) | ||
CH4 | CO2 | CO | |||
甲 | 300 | V1 | 0.02 | 0.02 | 0.10 |
乙 | 300 | V2 | x | x | 0.05 |
丙 | 350 | V1 | y | y | 0.12 |
下列说法正确的是( )
A.该反应在低温条件下不能自发进行
B.300 ℃时反应的平衡常数为25
C.V1∶V2=3∶7
D.保持温度和容器体积不变,开始时向甲容器中充入0.28 mol CO和0.28 mol H2,CO转化率一定大于2/7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com