
【题目】碳和硫单质及其化合物在工农业生产中有着重要的应用,CO2的过渡排放会导致温室效应,而SO2 直接排放会对环境造成危害。
I.有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
① 6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △Hl=-76.0kJ/mol
② C(s)+2H2O(g)=CO2(g)+2H2(g)△H2=+113.4kJ/mol
则反应:3FeO(s)+H2O(g)=Fe3O4(s)+H2(g)的△H=_______。
II. SO2的尾气处理通常有以下几种方法:
(l)活性炭还原法
反应原理:恒温恒容时,2C(s)+2SO2(g)===S2(g)+2CO2(g)。反应进行到不同时间测得各物质的浓度如图:

①0~20min反应速率表示为v(SO2)=_________;
②30min时,改变某一条件平衡发生移动,则改变的条件最有可能是________;
③4Omin时,平衡常数K=__________。
(2)亚硫酸钠吸收法
① Na2SO4溶液吸收SO2的化学方程式为______________;
② 常温下,当吸收至NaHSO3时,吸收液中相关离子浓度关系一定不正确的是_____(填序号)。
a. c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-)
b. c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
c. c(Na+)>c(HSO3-)>c(H+)>c(SO32-)
d.水电离出c(H+)=1×10-5mol/L
(3)电化学处理法

① 如图所示,Pt(II)电极的反应式为__________;
② 当电路中转移0.04mole-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加____mol离子。
【答案】 +18.7kJ/mol 0.03mol/(L·min) 减小CO2的浓度 0.675 Na2SO3+SO2+H2O=2NaHSO3 d 2HSO![]() +2e-+2H+=S2O
+2e-+2H+=S2O![]() +2H2O 0.06
+2H2O 0.06
【解析】(1)由盖斯定律:此反应△H=(①+②)÷2=(76.0kJ/mol+113.4kJ/mol)= +18.7kJ/mol;
II. ①0~20min时,SO2浓度变化为1.0mol/L-0.4mol/L=0.6mol/L,则反应速率表示为V(SO2)==0.03mol/(L·min),故答案为:0.03mol/(L·min);②30min时,CO2浓度减小,其他物质浓度不变,改变的条件是减小CO2的浓度,③40min时平衡常数和20min时相同,20min时,SO2(g)=0.4mol/L,S2(g)=0.3mol/L,CO2(g)=0.6mol/L,则平衡常数K=(0.3×0.62)/0.42=0.675。
(2)亚硫酸钠吸收法, ① Na2SO4溶液吸收SO2达最大量时的化学方程式为Na2SO3+SO2+H2O=2NaHSO3 ;② 常温下,当吸收至NaHSO3时,电离大于水解,溶液呈酸性,a. c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-)正确,b. (Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)电荷守恒正确,又HSO3—的电离大于水解,c. c(Na+)>c(HSO3-)>c(H+)>c(SO32-)正确,d.水电离出c(H+)肯定小于1×10-7mol/L,d错误。
(3)电化学处理法,① Pt(II)电极上发生还原反应,酸性介质,其反应式为:2HSO![]() +2e-+2H+=S2O
+2e-+2H+=S2O![]() +2H2O; ②当电路中0.04mole-时(较浓H2SO4尚未排出),由SO2+2H2O-2e-═SO42-+4H+,则交换膜左侧溶液中约增加0.06mol离子,故答案为:0.06。
+2H2O; ②当电路中0.04mole-时(较浓H2SO4尚未排出),由SO2+2H2O-2e-═SO42-+4H+,则交换膜左侧溶液中约增加0.06mol离子,故答案为:0.06。


科目:高中化学 来源: 题型:
【题目】下列各组物质依次满足如图所示直接转化关系的是
a | b | c | d | |
1 | Si | SiO2 | H2SiO3 | Na2SiO3 |
2 | S | SO2 | H2SO3 | H2SO4 |
3 | Na | NaOH | Na2CO3 | NaHCO3 |
4 | Fe | FeCl2 | Fe(OH)2 | Fe(OH)3 |
5 | Mg | MgO | Mg(OH)2 | MgSO4 |
6 | Al | Al2O3 | Al(OH)3 | NaAlO2 |

A. ①②③⑥ B. ②③ C. ②③⑥ D. ②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一篇名为《最终我坐着轮椅被推出了首都国际机场》的文章在网络上引发超过10万次点击。文中女留学在国外吸食笑气导致身体机能全面紊乱,坐轮椅回国。笑气成分是N2O,可作奶油发泡剂,但长期或大剂量滥用会导致神经及脊髓病变。一定条件下,N2O分解的部分实验数据如下表:
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O)/mol/L | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
下图能正确表示该反应有关物理量变化规律的是

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH4(g)+2O2(g)==CO2(g)+2H2O(1) △H = ―Q1 kJ/mol
2H2(g)+O2(g)==2H2O(g) △H = ―Q2 kJ/mol
2H2(g)+O2(g)==2H2O(1) △H = ―Q3kJ/mol
常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则放出的热量为
A. (0.4Q1+0.05Q3)kJ B. (0.4Q1+0.05Q2)kJ C. (0.4Q1+0.1Q3)kJ D. (0.4Q1+0.1Q2)kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物在氧气中充分燃烧,生成的水蒸气和CO2的物质的量之比为1:1,由此可得结论是
A. 该有机物分子中C、H、O个数比为1:2:3
B. 分子中碳氢原子个数比为2:1
C. 无法判断有机物中是否含有氧元素
D. 有机物中必定含氧元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)烧杯间填满碎泡沫塑料的作用是___________________________
(2)环形玻璃搅拌棒能否用环形铁质搅拌棒代替?_______(填“能”或“不能”), 其原因是____________________________。
(3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是___________________________。
实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应, 与上述实验相比,所放出的热量________________(填“相等”“不相等”),若实验操作均正确,则所求中和热_________(填“相等”“不相等”)。
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol H2O时,放出57.3 kJ的热量,则上述反应的热化学方程式为:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知SO2(g)+ 1/2 O2(g) ![]() SO3(g) △H = -98.30kJ/mol,现将4molSO2与一定量O2混合后充分反应,当放出314.56kJ热量时,SO2的转化率为_________________。
SO3(g) △H = -98.30kJ/mol,现将4molSO2与一定量O2混合后充分反应,当放出314.56kJ热量时,SO2的转化率为_________________。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g) △H= ―24.8kJ/mol
3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H= ―47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:_____________________________
(3)在一定条件下,CH4 和CO的燃烧的热化学方程式分别为:
CH4 ( g ) + 2O2 ( g ) = 2H2O ( l ) + CO2 ( g ) △H = -890 kJ/mol
2CO ( g ) + O2 ( g ) = 2CO2 ( g ) △H = -566 kJ/mol
一定量的CH4和CO的混合气体完全燃烧时,放出的热量为262.9 kJ,生成的CO2用过量的饱和石灰水完全吸收,可得到50 g白色沉淀。求混合气体中CH4 和CO的体积比_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 按系统命名法,有机物![]() 可命名为3,7﹣二甲基﹣4﹣乙基辛烷
可命名为3,7﹣二甲基﹣4﹣乙基辛烷
B. 1mol葡萄糖能水解生成2mol CH3CH2OH和2mol CO2
C. 醋酸和硬脂酸互为同系物,C2H6和C9H20也一定互为同系物
D. 丙氨酸和苯丙氨酸脱水,最多可生成3种二肽
查看答案和解析>>
科目:高中化学 来源: 题型:
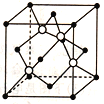
【题目】碳元素的单质存在多种同素异形体,下图依次是C60、石墨和金刚石的结构图。

(1)①C60属于__________晶体,石墨属于_________晶体。
②C60晶体、石墨和金刚石的熔点由高到低的顺序是_________。
(2)C60是一系列碳原子簇合物(即富勒烯)的一个典型代表,它的应用十分广泛,涉及光学、信息学、药物学、催化、储氢、超导等。
①目前,化学家已经找到十余种富勒烯家庭成员,如C28、C32、C50、C60……,它们的分子结构都是由正五边形和正六边形构成的封闭的凸多面体,多面体遵循欧拉定律:顶点数+面数-棱边数=2。则C80晶体结构中正五边形有_______个,C80晶体共有_____条棱。
②下列物质不属于富勒烯家庭的有_________(填序号)
A. C18 B. C44 C. C72 D. C83
(3)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性,其晶胞结构如图所示(其中·为碳原子,O为硅原子),每个碳原子周围与其距离最近的硅原子有____个;设晶胞边长为a nm,密度为bg·cm-3,则阿伏加德罗常数可表示为_______。(用含a、b的式子表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com