
【题目】A、B、C、D、E五种元素的原子序数依次增大,A原子无中子,B的单质在空气中含量最多,C、D元素同主族且原子序数D为C的二倍,E元素的价电子排布式为(n﹣l)d10+6ns1 , 回答下列问题:
(1)元素B在周期表中的位置是 .
(2)D元素基态原子的外围电子排布式为 .
(3)BC ![]() 的立体构型为 .
的立体构型为 .
(4)A元素与C元素形成两种常见的化合物,其原子个数比分别为2:1和1:1,两种化合物可以任意比互溶,原因是;其中一种化合物可在酸性条件下将KMnO4还原为Mn2+ , 写出相关反应的离子方程式:
(5)将过量BA3气体通入含E2+溶液中充分反应后生成的二价阳离子是(填离子符号),Imol该离子中含σ键为mol.
【答案】
(1)第二周期ⅤA族
(2)3S23P4
(3)平面三角形
(4)2MnO ![]() +5H2O2+6H+=2Mn2++5O2↑+8H2O
+5H2O2+6H+=2Mn2++5O2↑+8H2O
(5)[Cu(NH3)4]2+;16
【解析】解:A、B、C、D、E五种元素的原子序数依次增大,A原子无中子,则A为H元素;B的单质在空气中含量最多,则B为N则C为O元素、D为S元素;E元素的外围电子排布为(n﹣l)dn+6nsl , 则n+6=10,故n=4,故其外围电子排布为3d104sl , 则E为Cu;(1)B为N元素,处于周期表中第二周期VA族,所以答案是:第二周期VA族;(2)D为S,原子核外有16个电子,分3层排布,其电子排布式为1S22S22P63S23P4 , 所以基态原子的外围电子排布式为3S23P4;所以答案是:3S23P4;(3)NO3﹣的中心原子N的价层电子对数=3+ ![]() (5+1﹣3×2)=3,没有孤电子对,所以立体构型为平面三角型;所以答案是:平面三角型;(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,分别为H2O与H2O2 , 由于H2O与H2O2之间形成氢键,两种化合物可任意比互溶;过氧化氢能被酸性高锰酸钾氧化生成氧气,其反应的离子方程式为:2MnO4﹣+5H2O2+6H+=2Mn2++5O2↑+8H2O;所以答案是:H2O与H2O2之间形成氢键;2MnO4﹣+5H2O2+6H+=2Mn2++5O2↑+8H2O;(5)NH3与Cu2+通过配位键结合形成配离子[Cu(NH3)4]2+;[Cu(NH3)4]2+中共价键数目为12,配位键的数目为4,所以1mol该离子中含σ键为16mol;所以答案是:[Cu(NH3)4]2+;16.
(5+1﹣3×2)=3,没有孤电子对,所以立体构型为平面三角型;所以答案是:平面三角型;(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,分别为H2O与H2O2 , 由于H2O与H2O2之间形成氢键,两种化合物可任意比互溶;过氧化氢能被酸性高锰酸钾氧化生成氧气,其反应的离子方程式为:2MnO4﹣+5H2O2+6H+=2Mn2++5O2↑+8H2O;所以答案是:H2O与H2O2之间形成氢键;2MnO4﹣+5H2O2+6H+=2Mn2++5O2↑+8H2O;(5)NH3与Cu2+通过配位键结合形成配离子[Cu(NH3)4]2+;[Cu(NH3)4]2+中共价键数目为12,配位键的数目为4,所以1mol该离子中含σ键为16mol;所以答案是:[Cu(NH3)4]2+;16.


 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】胶体与其他分散系的本质区别在于( )
A. 胶体的分散系能通过滤纸空隙,而浊液的分散质不能
B. 分散质粒子直径大小不同
C. 产生丁达尔现象
D. 胶体在一定条件下能稳定存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将mg Al2O3和Fe2O3的混合物溶于100mL盐酸中,然后逐滴加入1mol/LNaOH溶液,其结果如图所示:
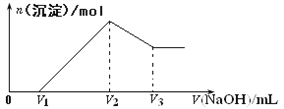
(1)最初加入V1mLNaOH溶液的作用是____________;
(2)盐酸的物质的量浓度是___________________;
(3)若mg混合物中Al2O3和Fe2O3按不同比例进行上述实验(其他条件不变),则V2的值会不会改变__________(填“会”或 “不会”),(V2—V1)的取值范围是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素为原子序数依次增大的短周期元素。A为原子半径最小的元素,A和B可形成4原子10电子的分子X;C的最外层电子数是内层的3倍;D原子的最外层电子数是最内层电子数的一半;E是地壳中含量最多的金属元素;F元素的最高正价与最低负价代数和为6。请回答下列问题:
(1)A和C按原子个数比1∶1形成4原子分子Y,Y的结构式是___________。
(2)分子X的电子式是__________;D可以在液态X中发生类似于与A2C的反应,写出反应的化学方程式_________________________________。
(3)实验证明,熔融的EF3 不导电,其原因是_______________________。
(4)E的单质可溶于A、C、D形成的化合物Z的水溶液中。拉曼光谱证实此反应生成的阴离子主要以E(CA)4- 的形式存在,写出E溶于Z溶液的离子方程式:_____________________。
(5)工业品Z的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
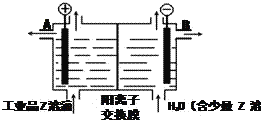
①该电解槽的阳极反应式是_________________。
②通电开始后,阴极附近溶液pH___________(“增大”、“减小”或“不变”)。
③除去杂质后的Z溶液从液体出口_________(填写“A”或“B”)导出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓H2SO4与浓HNO3的混合酸,加入反应器中;
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;
③在50~60℃下发生反应,直至反应结束;
④除去混合酸后,粗产品依次用蒸馏水和5% NaOH溶液洗涤,
最后再用蒸馏,水洗涤;
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯净硝基苯.
请填写下列空白:
(1)配制一定比例浓H2SO4与浓HNO3混合酸时,如何混合? .
(2)步骤③中,为了使反应在50~60℃下进行,常用的方法是;
(3)装置中常在试管上连接玻璃管,作用是什么? .
(4)步骤④中洗涤、分离粗硝基苯应使用的仪器是 .
(5)步骤④中粗产品用5% NaOH溶液洗涤的目的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是一种强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为NO2,稀硝酸的还原产物主要为NO。实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO。
(1)请写出实验室中用Cu与浓HNO3反应制取NO2的化学方程式:_____________。
(2)该反应中发生氧化反应的物质是__________,1 mol氧化剂_________(填“得到”或“失去”)_______ mol电子。
(3)48.0 g Cu与适量的浓HNO3反应,铜全部作用后,共收集到22.4 L气体(标准状况下),反应中消耗HNO3的物质的量可能是( )
A.1.5 mol B.2.0 mol C.2.5 mol D.3.0 mol
(4)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等。请将3种物质: FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
HNO3 + ______ ![]() ______ + ______ + N2O↑ + H2O
______ + ______ + N2O↑ + H2O
并写出配平后的离子方程式:_________________________。
(5)硝酸的还原产物NO、NO2、N2O等对环境均有副作用,为了可持续发展,当今社会提出的一个新概念——“绿色化学”,它要求从经济、环保和技术上设计可行的化学反应,则下列由单质铜制取硝酸铜的方法可行且符合“绿色化学”的是( )
A.Cu ![]() Cu(NO3)2
Cu(NO3)2
B.Cu ![]() CuO
CuO![]() Cu(NO3)2
Cu(NO3)2
C.Cu ![]() CuO
CuO![]() Cu(OH)2
Cu(OH)2 ![]() Cu(NO3)2
Cu(NO3)2
D.Cu![]() CuSO4
CuSO4 ![]() Cu(NO3)2
Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。某同学收集了该地区的雾霾,经必要的预处理后得试样溶液,设计并完成了如下的实验:
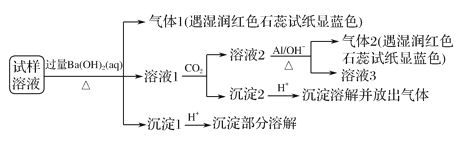
已知:3NO![]() +8Al+5OH-+2H2O
+8Al+5OH-+2H2O![]() 3NH3↑+8AlO
3NH3↑+8AlO![]() ,根据以上的实验操作与现象,该同学得出的结论不正确的是( )
,根据以上的实验操作与现象,该同学得出的结论不正确的是( )
A. 试样中肯定存在NH![]() 、Mg2+、SO
、Mg2+、SO![]() 和NO
和NO![]()
B. 试样中一定不含Al3+
C. 试样中可能存在Na+、Cl-
D. 该雾霾中可能存在NaNO3、NH4Cl和MgSO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com