
����Ŀ��A��B��C��D��E��F����Ԫ��Ϊԭ��������������Ķ�����Ԫ�ء�AΪԭ�Ӱ뾶��С��Ԫ�أ�A��B���γ�4ԭ��10���ӵķ���X��C���������������ڲ��3����Dԭ�ӵ����������������ڲ��������һ�룻E�ǵؿ��к������Ľ���Ԫ�أ�FԪ�ص��������������۴�����Ϊ6����ش��������⣺
��1��A��C��ԭ�Ӹ�����1��1�γ�4ԭ�ӷ���Y��Y�Ľṹʽ��___________��
��2������X�ĵ���ʽ��__________��D������Һ̬X�з�����������A2C�ķ�Ӧ,д����Ӧ�Ļ�ѧ����ʽ_________________________________��
��3��ʵ��֤�������ڵ�EF3 �����磬��ԭ����_______________________��
��4��E�ĵ��ʿ�����A��C��D�γɵĻ�����Z��ˮ��Һ�С���������֤ʵ�˷�Ӧ���ɵ���������Ҫ��E(CA)4�� ����ʽ���ڣ�д��E����Z��Һ�����ӷ���ʽ��_____________________��
��5����ҵƷZ����Һ�к���ijЩ����������ʣ��������ӽ���Ĥ������ᴿ��������װ�������ӽ���Ĥ��ֻ����������ͨ�������乤��ԭ����ͼ��ʾ��
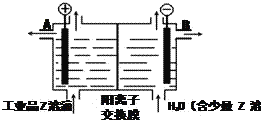
�ٸõ��۵�������Ӧʽ��_________________��
��ͨ�翪ʼ������������ҺpH___________������������С�����䡱����
�۳�ȥ���ʺ��Z��Һ��Һ�����_________����д��A����B����������
���𰸡� H��O��O��H ![]() 2Na��2NH3��2NaNH2��H2�� AlCl3 �����ڵ�״̬�²��������룬û�в��������ƶ������� 2Al��2OH����6H2O��2Al(OH)4����3H2�� 4OH����4e����2H2O��O2�� ���� B
2Na��2NH3��2NaNH2��H2�� AlCl3 �����ڵ�״̬�²��������룬û�в��������ƶ������� 2Al��2OH����6H2O��2Al(OH)4����3H2�� 4OH����4e����2H2O��O2�� ���� B
��������A��B��C��D��E��F����Ԫ��Ϊԭ��������������Ķ�����Ԫ��,AΪԭ�Ӱ뾶��С��Ԫ��,ΪHԪ��;A��B���γ�4ԭ��10���ӵķ���X,��BΪNԪ��;C���������������ڲ��3��,��CΪOԪ��;Dԭ�ӵ����������������ڲ��������һ��,ΪNaԪ��;E�ǵؿ��к������Ľ���Ԫ��,ΪAlԪ��;FԪ�ص��������������۴�����Ϊ6,��FΪClԪ����
(1)A��C��ԭ�Ӹ�����1��1�γ�4ԭ�ӷ���YΪH2O2,��ṹʽΪ, H��O��O��H ��ˣ�������ȷ����: H��O��O��H ��
(2)����X�ǰ���,����������ÿ��Hԭ�Ӻ�Nԭ���γ�һ�Թ��õ��Ӷ�,����ʽΪ![]() ;D��Na,�ƺͰ����ķ�Ӧ�൱�ں�ˮ�ķ�Ӧ,�����ƺ�ˮ�ķ�Ӧд���ƺͰ�����ӦΪ 2Na��2NH3��2NaNH2��H2��,��ˣ�������ȷ����:
;D��Na,�ƺͰ����ķ�Ӧ�൱�ں�ˮ�ķ�Ӧ,�����ƺ�ˮ�ķ�Ӧд���ƺͰ�����ӦΪ 2Na��2NH3��2NaNH2��H2��,��ˣ�������ȷ����:![]() ; 2Na��2NH3��2NaNH2��H2��
; 2Na��2NH3��2NaNH2��H2��
(3)�Ȼ����Ƿ��Ӿ���,����״̬���Է��Ӵ���,���ڵ�AlCl3 ������,��ˣ�������ȷ����:AlCl3 �����ڵ�״̬�²���������,û�в��������ƶ���������
(4)Al�ĵ��ʿ�����H��O��Na�γɵĻ�����NaOH��ˮ��Һ��.��������֤ʵ�˷�Ӧ���ɵ���������Ҫ��Al(OH)4������ʽ����,���ݷ�Ӧ�����������д���ӷ���ʽΪ2Al��2OH����6H2O��2Al(OH)4����3H2����ˣ�������ȷ����:2Al��2OH����6H2O��2Al(OH)4����3H2��
(5)���õ��۵����������������ӷŵ�,�缫��ӦʽΪ4OH����4e����2H2O��O2��,��ˣ�������ȷ����:4OH����4e����2H2O��O2����
��ͨ�翪ʼ��,������ˮ�õ�����������ͬʱ��������������,����������������������Ũ������,����pH����,��ˣ�������ȷ����:������
��������������������������,������ͨ������Ĥ���������ҵõ�NaOH,�����������ҵõ�NaOH,���Դ�B����,��ˣ�������ȷ����:B.



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ºϳ�·�ߣ�������ת��Ϊ����������������ȷ���ǣ� �� 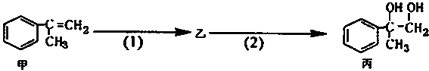
A.���п��ܺ���δ��Ӧ�ļף�������ˮ�����Ƿ�
B.��Ӧ��1�������Լ���Һ�壬��������
C.�ͱ�����������KMnO4��Һ������Ӧ
D.��Ӧ��2����Ӧ����ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ���(SO2Cl2)��һ����Ҫ���л��ϳ��Լ���ʵ���ҿ�����SO2��Cl2��Ӧ��ȡ������SO2Cl2��װ����ͼ����Щ֧��װ��ʡ���ˣ���ʾ��
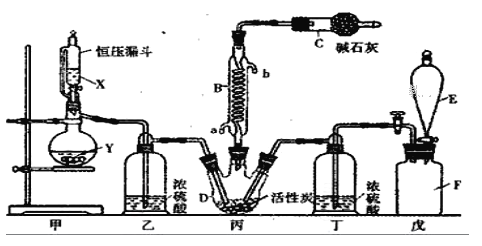
��֪SO2Cl2���۵�Ϊ-54.1�����е�Ϊ69. 1���������±Ƚ��ȶ��������ֽ⣬��ˮ�ܷ������ҵ�ˮ�ⷴӦ������֮һΪ�Ȼ������塣
��1����������װ�ã� Fƿ�е�������ʹʪ�����ɫ������ɫ����Fƿ�е������ʵ�����Ʒ���________________________________���÷���ʽ��ʾ����
��2��B����Ӧ����ȴˮӦ��__________(����a������b��)�ӿ�ͨ�룻C����������Ϊ____________����ʯ�ҵ�����Ϊ____________��
��3��װ���ҺͶ���������____________��
��4����ѹ©����������Ľṹ����ҪĿ����___________��
��5��д�����Ȼ���(SO2Cl2)ˮ�ⷴӦ�ķ���ʽ________________��
��6��SO2����ˮ���������ᣬ�����������ǿ�ڴ����ᣬѡ�������װ�ú�ҩƷ̽��������������������ǿ����

װ������˳��ΪA��_______��______��______��D��F������E��������____________��ͨ��________________����֤�������������ǿ�ڴ����ᡣ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Na2CO3��NaHCO3���ʵ�˵����ȷ����
A. ��ˮ�е��ܽ���: NaHCO3>Na2CO3
B. ���ȶ�����NaHCO3<Na2CO3
C. ���ᷴӦ�ľ��ҳ̶�: NaHCO3<Na2CO3,
D. ֻ����NaHCO3ת����Na2CO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(SO2Cl2)�����Ȼ�������諻�������������ҩƷ��Ⱦ�ϡ�������Լ��ȡ��й����ʵIJ����������±���
���� | �۵�/�� | �е�/�� | �������� |
SO2Cl2 | -54.1 | 69.1 |
���ֽ���SO2Cl2 SO2��+Cl2�� |
H2SO4 | 10.4 | 338 | ������ˮ���Ҳ��ֽ� |
ʵ�����ø���������Ķ�������������ϳ������ȣ���Ӧ�Ļ�ѧ����ʽΪSO2(g)+Cl2(g) ![]() SO2Cl2(l)��H=-97.3kJ/mol��װ����ͼ��ʾ���г�������ʡ�ԣ�����ش��й����⣺
SO2Cl2(l)��H=-97.3kJ/mol��װ����ͼ��ʾ���г�������ʡ�ԣ�����ش��й����⣺

��1������B��������_____________________��
��2������װ���������Ȼᷢ��ˮ�⣬��������ˮ�ⷴӦ�Ļ�ѧ����ʽΪ________________��
��3��д����װ���з�����Ӧ�Ļ�ѧ��Ӧ����ʽ��������ӵ�ת��__________________��
��4��Ϊ��߱�ʵ���������ȵIJ��ʣ���ʵ���������Ҫע���������_________(�����)
����ͨ����ˮ����ͨ�� �ڿ����������ʣ��������˿�
����������ƿ���̣����ʵ����� �ܼ���������ƿ
��5������������Ҳ�����Ȼ���(ClSO3H)�ֽ��ã��÷�Ӧ�Ļ�ѧ����ʽΪ________________________���˷����õ��IJ�Ʒ�л�������ᡣ�ӷֽ�����з���������ȵķ�����___________________��
��6����ҵ�ϴ���SO2�����ķ����ܶ࣬���������Fe2(SO4)3������Һ�������乤������������Һ��ת��Ϊ��Һ�۷�����Ӧ�����ӷ���ʽΪ__________________________ ��
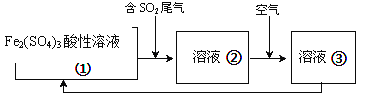
�еĹ����õ�ⷨ��������SO2��β������װ������ͼ��ʾ���缫���Ͼ�Ϊ���Ե缫��������˵������ȷ����_______
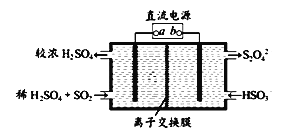
A���缫a���ӵ��ǵ�Դ������
B������·��ת��0.03mole-�������ӽ���Ĥ�����Һ������0.03mol����
C��ͼ�е����ӽ���Ĥ�������ӽ���Ĥ
D�������ĵ缫��ӦʽΪ2HSO3-+2e-+2H+==S2O42-+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�����õ�ⱥ��ʳ��ˮ��������(Cl2)���ռ�������Ļ�ѧ����ʽ��:2NaCl + 2H2O![]() 2NaOH + Cl2��+ H2��
2NaOH + Cl2��+ H2��
��1����˫���ű�ʾ������ת�Ƶķ������Ŀ______________������з�Ӧ��д�����ӷ���ʽ��___________________________________
��2�����ʳ��ˮ�Ĺ����У�����������__________________________________
��3�����ʳ��ˮҪ��Դ�ʳ��ˮ���о��ƣ��Գ�ȥ��ʳ��ˮ�к��е���ɳ��SO42-��Ca2+,Mg2+���������ӡ�����ʱ���μ����Ȼ�����Һ������ռ��ַ�Ӧ����ˣ�����Һ�м��������к������ԡ���������Һ��Ӧ�����ӷ���ʽ:____________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E����Ԫ�ص�ԭ��������������Aԭ�������ӣ�B�ĵ����ڿ����к�����࣬C��DԪ��ͬ������ԭ������DΪC�Ķ�����EԪ�صļ۵����Ų�ʽΪ��n��l��d10+6ns1 �� �ش��������⣺
��1��Ԫ��B�����ڱ��е�λ���� ��
��2��DԪ�ػ�̬ԭ�ӵ���Χ�����Ų�ʽΪ ��
��3��BC ![]() �����幹��Ϊ ��
�����幹��Ϊ ��
��4��AԪ����CԪ���γ����ֳ����Ļ������ԭ�Ӹ����ȷֱ�Ϊ2��1��1��1�����ֻ������������Ȼ��ܣ�ԭ���ǣ�����һ�ֻ�����������������½�KMnO4��ԭΪMn2+ �� д����ط�Ӧ�����ӷ���ʽ��
��5��������BA3����ͨ�뺬E2+��Һ�г�ַ�Ӧ�����ɵĶ������������������ӷ��ţ���Imol�������к��Ҽ�Ϊmol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A��һԪ���ᣬ��C��H��OԪ����ɣ�����������C%40%��H 6.67%��ȡ0.60g A�����Һ���ú�0.01mol NaOH ����Һ��ǡ����ȫ�кͣ�
��1��A�����ʽΪ�����ʽ��Ϊ ��
��2��A����Է�������Ϊ������ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�������ԭ��Ӧ�������������
A.���ֽⷴӦһ������������ԭ��Ӧ
B.������ԭ��Ӧһ����Ԫ�ػ��ϼ۵�����
C.������ԭ��Ӧ���������ͻ�ԭ��������ͬһ������
D.������ʧ���ӣ�����ԭ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com