
【题目】漳州市海水资源丰富,漳浦盐场是福建省第三大国有盐场,盐田面积达700万平方米,每年产盐5万多吨。海水化学资源(主要为NaCl和MgSO4及K、Br等元素)的利用具有非常广阔的前景。

回答下列问题:
⑴NaClO3中氯的化合价_____________。
⑵在a、b、c、d提取镁的过程中,没有涉及的化学反应类型是_________(填序号)。
①分解反应 ②化合反应 ③复分解反应 ④置换反应
⑶苦卤中通入氯气发生的主要离子反应方程式为___________________________________。⑷步骤a中的沉淀剂是____________________。
⑸步骤d中,电解熔融MgCl2得到的镁需要在保护气中冷却,下列气体可以作为保护气的是____________(填序号)。
①N2 ②H2 ③CO2 ④空气
⑹假设该海域海水中MgCl2浓度9.5×10-3g·L-1 ,欲获得24g金属镁需要________L海水。
【答案】+5 ②④ Cl2 + 2Br- === Br2 + 2Cl- 石灰乳或Ca(OH)2 ② 1.0×104
【解析】
本题就是课本上的海水提盐的流程图,据此来作答即可。
(1)钠为+1价,氧为-2价,所以氯酸钠中的氯是+5价的;
(2)a是将镁离子引入沉淀池变成![]() 沉淀,发生的是复分解反应,b是将
沉淀,发生的是复分解反应,b是将![]() 加酸转变为
加酸转变为![]() ,依然是复分解反应;c是将含水的氯化镁分解变成无水氯化镁,属于分解反应,d是电解将氯化镁分解成单质镁和氯气,仍然属于分解反应,因此①③有涉及,②④未涉及,答案选②④;
,依然是复分解反应;c是将含水的氯化镁分解变成无水氯化镁,属于分解反应,d是电解将氯化镁分解成单质镁和氯气,仍然属于分解反应,因此①③有涉及,②④未涉及,答案选②④;
(3)苦卤中的![]() 可以与
可以与![]() 发生非金属间的置换反应:
发生非金属间的置换反应:![]() ;
;
(4)从节约成本的角度分析,流程中的沉淀剂为石灰乳;
(5)要想做保护气那么必然不能与被保护的物质发生反应,选项中只有②![]() 不与镁发生反应,其它物质都会与镁发生反应,答案选②;
不与镁发生反应,其它物质都会与镁发生反应,答案选②;
(6)![]() 的浓度已知,则
的浓度已知,则![]() 的浓度也已知,为
的浓度也已知,为![]() (95为
(95为![]() 的分子量),若要得到24g金属镁,由
的分子量),若要得到24g金属镁,由![]() 解出需要的海水体积。
解出需要的海水体积。


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】1.28g铜投入一定量的浓硝酸中,铜完全溶解,生成气体颜色越来越浅,共收集到VmL气体(标准状况),将盛有此气体的容器倒扣在水中,通入氧气恰好使气体完全溶解在水中,则需要标准状况下的氧气体积为( )
A. 504mLB. 336mLC. 224mLD. 168mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是极其重要的化学元素。我国科学家最近成功合成了超高含能材料聚合氮和金属氮。基于氮气的能源研究也是未来能源发展的重要方向。
(1)基态氮原子的价电子排布式为___________。
(2)14g氮气分子中原子轨道以“头碰头”方式形成的共价键数目为___________,以“肩并肩”方式形成的共价键数目为___________。
(3)C、N、O三种元素按第一电离能从大到小的排列顺序为___________。已知氧的第一电离能为1369kJ·mol-1、第二电离能为3512kJ·mol-1、第三电离能为5495kJ·mol-1,其第二电离能增幅较大的原因是__________________。
(4)某含氨配合物CrCl3·6NH3的化学键类型有配位键、极性共价键和___________。CrCl3·6NH3有三种异构体,按络离子式量增大的顺序分别是[Cr(NH3)6]Cl3、___________、[Cr(NH3)4Cl2]Cl·2NH3。
(5)NH4N3是高能量度材料,其晶胞如下图所示。N3-是直线型结构,N3-中氮原子的杂化类型是___________。在VSEPR模型中NH4+的几何构型名称为______________。
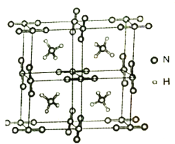
(6)已知NH4N3的晶胞参数为anm和0.5anm,阿伏加德罗常数的值为NA,则NH4N3的密度为_________________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上冶炼锡的第一步反应为![]() ,则下列说法中错误的是( )
,则下列说法中错误的是( )
A.a的值为2B.反应中SnO2被还原
C.反应后有两种氧化产物D.1mol SnO2参加反应电子转移8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有六种物质:①Cl2 ②CaO ③Na2CO3溶液 ④蔗糖 ⑤BaCl2晶体 ⑥CO2
⑴属于电解质的是__________________(填序号,下同);属于非电解质的是_________。
⑵属于碱性氧化物的是_________________。
⑶写出⑤溶于水的电离方程式__________________________________。
⑷写出③与⑥反应的化学方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,向A中充入1molX、1molY,向B中充入2molX、2molY,起始时A、B的体积相等都等于aL,在相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述放热反应,X(g)+Y(g)![]() 2Z(g)+W(g);A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL.下列说法错误的( )
2Z(g)+W(g);A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL.下列说法错误的( )
![]()
A. 反应速率:v(B)>v(A) B. A容器中X的转化率为80%
C. 平衡时的压强:PB>2PA D. 平衡时Y体积分数:A>B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。在如图所示的物质转化关系中,p、q、 m、n分别是元素W、X、Y、Z的气体单质,p和 s均为有色气体,v的水溶液呈碱性。常温下,0.1 mol L -1t 溶液与 0.1 mol L -1 u 溶液的pH均为1。下列说法不正确的是
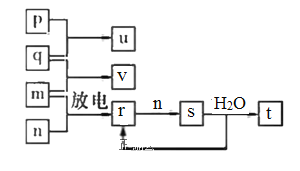
A.Y、W的最高价氧化物对应的水化物均为强酸
B.Z和Y的简单氢化物的稳定性和沸点高低均为:Z>Y
C.s溶于水的反应中,氧化剂与还原剂的物质的量之比为1:2
D.v的电子式可表示为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据已学《物质结构与性质》的有关知识,回答下列问题:
(1)如图所示是元素周期表中第一、第二周期10种元素的某些性质的一组数据(所列数据的单位相同),除带“…”的四种元素外,其余元素都给出了该种元素的全部该类数据。
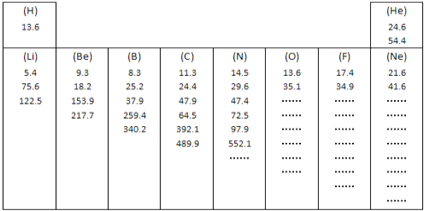
有些元素的逐级电离能中个别地方增大的比例(倍数)特别大,形成“突跃”,由此可以证明原子结构中_______________________的结论。根据这个规律,你认为氧元素8个电离能数据中出现“突跃”的数据应该是第________个。
(2)在①苯 ②CH3OH ③HCHO ④CS2 ⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有_____(填序号),易溶于水的有_____(填序号),理由是:____________。
(3)N≡N键的键能为946kJ·mol-1,N—N键的键能为193kJ·mol-1,则一个π键的平均键能为__________,说明N2中________键更稳定(填“σ”或“π”)。
(4)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续滴加氨水,难溶物溶解,得到深蓝色的透明溶液,写出有关化学反应的离子方程式___________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高。
(1)若电解质溶液为硫酸,其正极反应式为____________________,负极反应式为___________________;若在常温下转移2mol电子,可产生水质量为_________g。
(2)若用氢氧燃料电池电解由NaCl和CuSO4组成的混合溶液,其中c(Na+)=3c(Cu2+)=3mol·L—1,取该混合液100mL用石墨做电极进行电解,通电一段时间后,在阴极收集到1.12L(标准状况)气体。此时氢氧燃料电池中消耗H2的质量是_______,混合溶液中NaOH的物质的量浓度是__________mol·L-1。
(3)已知可逆反应:AsO43-+2I-+2H+![]() AsO33-+I2+H2O。如图所示,C1棒和C2棒都是石墨电极。
AsO33-+I2+H2O。如图所示,C1棒和C2棒都是石墨电极。
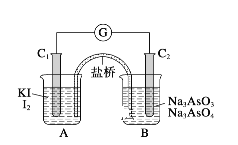
(Ⅰ)若向B中逐滴加入浓盐酸,上述反应向右进行,发现检流计指针向左偏转。
(Ⅱ)若改用向B中滴加40%的NaOH溶液,发现检流计指针与(Ⅰ)中偏转方向相反。
试回答问题:
操作(Ⅰ)中,C1棒上的反应式为_____________________________。
操作(Ⅱ)中,C2棒上的反应式为______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com