
【题目】现有六种物质:①Cl2 ②CaO ③Na2CO3溶液 ④蔗糖 ⑤BaCl2晶体 ⑥CO2
⑴属于电解质的是__________________(填序号,下同);属于非电解质的是_________。
⑵属于碱性氧化物的是_________________。
⑶写出⑤溶于水的电离方程式__________________________________。
⑷写出③与⑥反应的化学方程式________________________________。
【答案】②⑤ ④⑥ ② BaCl2===Ba2++2Cl- Na2CO3 + CO2 + H2O === 2NaHCO3
【解析】
电解质是水溶液中或熔融状态下能导电的化合物,通常包括酸、碱、盐、活泼金属氧化物及水,据此来解题即可。
(1)根据分析,氧化钡熔融时导电,氯化钡溶于水或熔融均导电,故②⑤属于电解质,蔗糖在水溶液中和熔融状态下均不导电,二氧化碳自身不能电离出离子,不能导电,故④⑥属于非电解质;
(2)碱性氧化物是能与酸反应生成盐和水的化合物,氧化钙与盐酸反应生成氯化钙和水,符合条件的只有②;
(3)氯化钡是强电解质,完全电离,用等号来连接,因此氯化钡的电离方程式为![]() ;
;
(4)碳酸钠和二氧化碳可以发生反应得到碳酸氢钠:![]() 。
。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】常温下,在 20mL、c mol·L-1某酸 HR 溶液中滴加 0.1000mol·L-1氢氧化钠溶液,溶液的 pH 与氢氧化钠溶液体积 V(NaOH)之间关系如图所示。下列说法一定不正确的是( )
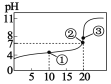
A.c=0.1
B.HR 的电离方程式为 HR H+ +R-
C.①点对应溶液中存在 c(R-)>c(Na+)>c(H+)>c(OH-)
D.在①②③点对应的溶液中都存在 c(OH-)=c(H+)+c(HR)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个密闭容器中发生如下反应:2SO2(g) + O2(g) ![]() 2SO3(g),反应过程中某一时刻测得SO2、O2、SO3的浓度分别为:0.2 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能出现的数据是( )
2SO3(g),反应过程中某一时刻测得SO2、O2、SO3的浓度分别为:0.2 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能出现的数据是( )
A. c(SO3)=0.4 mol·L-1B. c(SO2)=c(SO3)=0.15 mol·L-1
C. c(SO2)=0.25 mol·L-1D. c(SO2) + c(SO3)=0.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. BaSO4难溶于水,其属于弱电解质
B. 强电解质的导电能力一定比弱电解质的导电能力强
C. 弱电解质一定是共价化合物
D. H2O能发生微弱电离,是一种弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的化合物应用非常广泛,刻制印刷电路板时要用FeCl3溶液为腐蚀液,其反应的化学方程式为:2FeCl3+Cu =2FeCl2+CuCl2
⑴该反应的氧化剂是_______________________(填化学式)。
⑵请用双线桥法标出该反应电子的转移的方向和数目。2FeCl3+Cu =2FeCl2+CuCl2_____________________
⑶使用过的腐蚀液会失效,但还可以回收利用,其中有一步需要将Fe2+转化为Fe3+,下列试剂能实现上述变化的是_____________________________(填序号)。
①氯气 ②铁 ③盐酸 ④稀硫酸
⑷某久置的FeCl2溶液略显黄色,某同学认为可能有部分Fe2+被氧化为Fe3+,因此配制FeCl2溶液时需加少量铁粉,请写出Fe3+转化为Fe2+的离子方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】漳州市海水资源丰富,漳浦盐场是福建省第三大国有盐场,盐田面积达700万平方米,每年产盐5万多吨。海水化学资源(主要为NaCl和MgSO4及K、Br等元素)的利用具有非常广阔的前景。

回答下列问题:
⑴NaClO3中氯的化合价_____________。
⑵在a、b、c、d提取镁的过程中,没有涉及的化学反应类型是_________(填序号)。
①分解反应 ②化合反应 ③复分解反应 ④置换反应
⑶苦卤中通入氯气发生的主要离子反应方程式为___________________________________。⑷步骤a中的沉淀剂是____________________。
⑸步骤d中,电解熔融MgCl2得到的镁需要在保护气中冷却,下列气体可以作为保护气的是____________(填序号)。
①N2 ②H2 ③CO2 ④空气
⑹假设该海域海水中MgCl2浓度9.5×10-3g·L-1 ,欲获得24g金属镁需要________L海水。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸,![]() 增大
增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某NaOH溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示四种情况,且(2)、(3)、(4)图中分别有OA﹕AB=2﹕3, OA=AB, OA﹕AB=3﹕2,则下列分析与判断不正确的是(忽略CO2的溶解)( )

A. M中只有一种溶质的有(1)和(3)
B. M中有两种溶质的有(2)和(4)
C. (2)图显示M中的溶质为NaHCO3和Na2CO3,二者的物质的量之比为2:1
D. (4)图显示M中的溶质为NaOH和Na2CO3,二者的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)天然气是一种清洁高效的能源,其主要成分为甲烷。
CH4的摩尔质量为_____________, 4.8 g CH4的物质的量为______________,在标准状况下的体积约为_______________,所含氢原子数为_______________。
(2)某化学兴趣小组对某矿泉水进行检测, 发现0.5 L该矿泉水中含有10.8 mg Mg2+,则Mg2+的物质的量浓度为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com