
【题目】在一个密闭容器中发生如下反应:2SO2(g) + O2(g) ![]() 2SO3(g),反应过程中某一时刻测得SO2、O2、SO3的浓度分别为:0.2 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能出现的数据是( )
2SO3(g),反应过程中某一时刻测得SO2、O2、SO3的浓度分别为:0.2 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能出现的数据是( )
A. c(SO3)=0.4 mol·L-1B. c(SO2)=c(SO3)=0.15 mol·L-1
C. c(SO2)=0.25 mol·L-1D. c(SO2) + c(SO3)=0.5 mol·L-1
【答案】C
【解析】
反应过程中某一时刻测得SO2,O2,SO3的浓度分别为:0.2molL-1,0.2molL-1,0.2molL-1,假设二氧化硫和氧气转化为三氧化硫,当二氧化硫完全转化时,氧气有0.1mol/L的转化,生成0.2mol/L三氧化硫,此时c(SO2)=0、c(O2)=0.1mol/L、c(SO3)=0.4mol/L;
假设三氧化硫完全转化为二氧化硫和氧气,则c(SO2)=0.4mol/L、c(O2)=0.3mol/L、c(SO3)=0mol/L,实际上存在平衡状态,所以存在0<c(SO2)<0.4mol/L、0.1mol/L<c(O2)<0.3mol/L、0<c(SO3)<0.4mol/L。
A.c(SO3)=0.4 mol·L-1,不满足0<c(SO3)<0.4mol/L,故A错误;
B.c(SO2)=c(SO3)=0.15 mol·L-1,c(SO2)、c(SO3)不可能都减小,故B错误;
C.c(SO2)=0.25 mol·L-1,满足0<c(SO2)<0.4mol/L,故C正确;
D.根据方程式2SO2(g) + O2(g) ![]() 2SO3(g),c(SO2) + c(SO3)=0.4 mol·L-1,故D错误;
2SO3(g),c(SO2) + c(SO3)=0.4 mol·L-1,故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】根据下列电离方程式判断,下列分组正确的是( )
①H2SO4===2H++![]() 、②Ba(OH)2===Ba2++2OH-、③KAl(SO4)2===K++Al3++2
、②Ba(OH)2===Ba2++2OH-、③KAl(SO4)2===K++Al3++2![]() 、④NaHSO4===Na++H++
、④NaHSO4===Na++H++![]()
A. 属于酸的是①④ B. 属于碱的是②
C. 属于盐的只有③ D. 属于盐的只有④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙以及物质C、D、E、F,它们之间能发生如下反应。(图中有些反应的产物和反应条件没有标出)
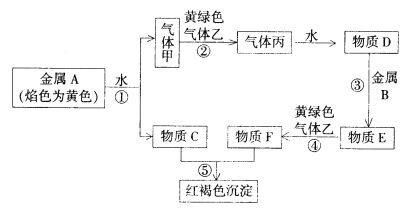
(1)A的原子结构示意图为_____________,丙的化学式为_____________。
(2)金属A、B和气体甲、乙、丙以及物质C、D、E、F中不能导电的有__________________ 、属于电解质的有___________ 。(填“A”“B”“甲”“乙”“丙”“C”“D”“E”“F”)
(3)写出转化①发生的化学方程式:____________________,写出转化④发生的离子方程式:____________________。
(4)将Na2O2投入到E溶液中,可以观察到的现象是:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应4CO+2NO2![]() N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
A. υ(CO)=1.5 mol·L-1·min-1 B. υ(NO2)=0.7 mol·L-1·min-1
C. υ(N2)=0.4 mol·L-1·min-1 D. υ(CO2)=1.1 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“银-Ferrozine”法测室内甲醛含量的原理为:

已知:吸光度与溶液中有色物质的浓度成正比
下列说法正确的是
A. 反应①中参与反应的HCHO为30g时转移电子2mol
B. 可用双氧水检验反应②后的溶液中是否存在Fe3+
C. 生成44.8 LCO2时反应②中参加反应的Ag一定为8mol
D. 理论上测得溶液吸光度越高,HCHO含量也越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是极其重要的化学元素。我国科学家最近成功合成了超高含能材料聚合氮和金属氮。基于氮气的能源研究也是未来能源发展的重要方向。
(1)基态氮原子的价电子排布式为___________。
(2)14g氮气分子中原子轨道以“头碰头”方式形成的共价键数目为___________,以“肩并肩”方式形成的共价键数目为___________。
(3)C、N、O三种元素按第一电离能从大到小的排列顺序为___________。已知氧的第一电离能为1369kJ·mol-1、第二电离能为3512kJ·mol-1、第三电离能为5495kJ·mol-1,其第二电离能增幅较大的原因是__________________。
(4)某含氨配合物CrCl3·6NH3的化学键类型有配位键、极性共价键和___________。CrCl3·6NH3有三种异构体,按络离子式量增大的顺序分别是[Cr(NH3)6]Cl3、___________、[Cr(NH3)4Cl2]Cl·2NH3。
(5)NH4N3是高能量度材料,其晶胞如下图所示。N3-是直线型结构,N3-中氮原子的杂化类型是___________。在VSEPR模型中NH4+的几何构型名称为______________。
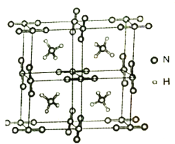
(6)已知NH4N3的晶胞参数为anm和0.5anm,阿伏加德罗常数的值为NA,则NH4N3的密度为_________________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数,下列说法中正确的是( )
A.18g水含有电子数为9NA
B.常温常压下,71g氯气含有氯原子数为NA
C.标准状况下,22.4L氢气含有的氢原子数为2NA
D.1mol冰醋酸溶于水中,所得溶液中H+ 数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有六种物质:①Cl2 ②CaO ③Na2CO3溶液 ④蔗糖 ⑤BaCl2晶体 ⑥CO2
⑴属于电解质的是__________________(填序号,下同);属于非电解质的是_________。
⑵属于碱性氧化物的是_________________。
⑶写出⑤溶于水的电离方程式__________________________________。
⑷写出③与⑥反应的化学方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)分别取W g钠、铁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是________。
(2)分别取0.1 mol钠、铁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是______。
(3)若产生相同物质的量的氢气,反应所需钠、铁、铝的质量比是____________。
(4)若产生相同体积(同温、同压)的氢气,反应所需钠、铁、铝三种金属的物质的量之比是____。
(5)分别取金属钠、铁、铝0.2 mol,分别投入10 mL 1 mol·L-1盐酸中,在标准状况下产生氢气的体积大小的顺序是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com