
【题目】(1)分别取W g钠、铁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是________。
(2)分别取0.1 mol钠、铁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是______。
(3)若产生相同物质的量的氢气,反应所需钠、铁、铝的质量比是____________。
(4)若产生相同体积(同温、同压)的氢气,反应所需钠、铁、铝三种金属的物质的量之比是____。
(5)分别取金属钠、铁、铝0.2 mol,分别投入10 mL 1 mol·L-1盐酸中,在标准状况下产生氢气的体积大小的顺序是___________。
【答案】(1)![]() :
:![]() :
:![]() (2)1:2:3.
(2)1:2:3.
(3)23:12:9.(4)6:3:2.(5)Na>Mg=Al
【解析】试题分析:钠、镁和铝在反应中分别失去1、2、3个电子,则
(1)分别取Wg钠、镁、铝与足量的盐酸反应,在相同条件下产生H2的体积比![]()
![]() :
:![]() :
:![]() 。
。
(2)分别取0.1mol 钠、镁、铝与足量的盐酸反应,在相同条件下产生H2的体积比是0.05:0.1:0.15=1:2:3。
(3)若产生相同物质的量的H2,假设都是1mol,则所需钠、镁、铝的质量比为![]() 23:12:9。
23:12:9。
(4)若产生相同体积(同温同压下)的H2,由于体积之比是相应的物质的量之比,假设都是1mol,则所需的钠、镁、铝物质的量比为![]() 6:3:2。
6:3:2。
(5)若将0.2mol钠、镁、铝分别投入到10mL 1molL﹣1的盐酸中,盐酸均不足,钠是活泼的金属,一定产生0.1mol氢气,镁、铝产生的氢气相等均是0.005mol,因此在标准状况下,产生体积H2的大小顺序是Na>Mg=Al。


科目:高中化学 来源: 题型:
【题目】下列电解质溶液的有关叙述正确的是( )
A.同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7
B.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
C.含1 mol KOH的溶液与1 mol CO2完全反应后,溶液中c(K+)= c(HCO3-)
D.在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)= c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)被联合国世界卫生组织(WHO)列为AⅠ级高效安全灭菌消毒剂。常温下二氧化氯为黄绿色气体,其熔点为-59.5℃,沸点为11.0℃,能溶于水,不与水反应。温度过高,二氧化氯的水溶液可能爆炸。某研究性学习小组拟用下图所示装置制取并收集ClO2。(加热和夹持装置均省略)

(1)在圆底烧瓶中先放入一定量的KClO3和草酸(H2C2O4),然后再加入足量的稀硫酸,在60℃~80℃之间生成C1O2、CO2和一种硫酸盐,该反应的化学方程式为____________________。
(2)A装置中使用温度计的目的________________。反应开始后,可以观察到圆底烧瓶内的现象是________。
(3)B装置的作用是______________。
(4)D装置中的NaOH溶液吸收尾气中的ClO2,生成物质的量之比为的1:1的两种盐,一种为NaClO2,另一种为________。
(5)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:量取ClO2溶液10.0mL,稀释成100.,0mL试样;量取V1mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,振荡后,静置片刻;
步骤3:加入指示剂X,用cmol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
(已知:2ClO2+8H++10I-=5I2+2Cl-+4H2O;2Na2S2O3+I2=Na2S4O6+2NaI)
指示剂X为________。原ClO2溶液的浓度为_________g·L-1(用含字母的代数式表示)。
(6)有同学认为KC1O3在酸性条件下与草酸反应会生成KCl。请设计实验证明A装置反应后的溶液中是否存在C1-,简要写出所需试剂、实验操作、现象和结论。(已知:AgClO3可溶于水)
_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取两种金属组成的混合物8.0 g,加入足量稀硫酸,反应后得到5.6 L标准状况下的气体,则混合物可能是( )
A. Al和Mg B. Al和Zn C. Fe和Cu D. Zn和Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中,B、D、E、F、G是氧化物,F、K是氢化物,C、H是日常生活中最常见的金属单质,J是气态非金属单质。O是白色沉淀且B、H、L、M、N、O中含有同种元素,I的产量是衡量一个国家化工生产水平的重要标志(图中部分反应物和生成物没有列出)。
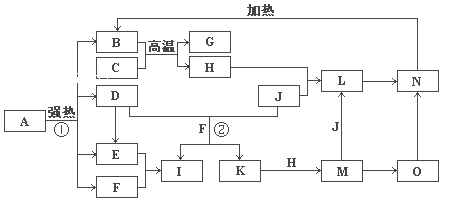
请按要求回答:
⑴写出G、L的化学式G:______,L:____________。
⑵反应②的离子方程式 ___________________________。
⑶反应①是分解反应,反应中生成的B、D、E、F的物质的量之比为
1∶1∶1∶14,则该反应的化学方程式为 ________________________。
⑷将A直接溶于水(未加稀硫酸酸化)得到的溶液,敞口久置,变质过程中涉及的离子方程式为 ______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有关下列溶液的说法不正确的是
A. 20mL0.1mol/LCH3COONa溶液与 10mL0.1mol/LHCl溶液混合后呈酸性,所得溶液中:
c(CH3COO-)c(Cl-)c(CH3COOH)c(H+)
B. 0.1mol/L Na2C2O4溶液与 0.1mol/L HCl 溶液等体积混合,所得溶液中:
2c(C2O42-)+c(HC2O4-)+ c(OH-)= c(Na+)+ c(H+)
C. 含等物质的量的NaHC2O4和Na2C2O4的溶液中:2 c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)]
D. 将amol/L氨水与0.01mol/L 盐酸等体积混合,若反应完全时溶液中 c(NH4+)=c(Cl-),则NH3·H2O的电离常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 浓硫酸溅到皮肤上,立即用稀氢氧化钠溶液冲洗
B. 分馏实验,温度计应该在混合溶液中以便准确测量混合溶液的温度
C. 分液漏斗分液,放出下层液体后再从分液漏斗下口放出上层液体
D. 制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为__________________。
(2)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为____________________。
(3)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是___________。
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-) D.c(OH-)/c(H+)
E.![]()
若该溶液升高温度,上述5种表达式的数据增大的是___________________。
(4)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程中pH变化如图所示。

则相同条件下HX的电离平衡常数__________________(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是____________________,稀释后,HX溶液中由水电离出来的c(H+)______________(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+),理由是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com