
【题目】氮是极其重要的化学元素。我国科学家最近成功合成了超高含能材料聚合氮和金属氮。基于氮气的能源研究也是未来能源发展的重要方向。
(1)基态氮原子的价电子排布式为___________。
(2)14g氮气分子中原子轨道以“头碰头”方式形成的共价键数目为___________,以“肩并肩”方式形成的共价键数目为___________。
(3)C、N、O三种元素按第一电离能从大到小的排列顺序为___________。已知氧的第一电离能为1369kJ·mol-1、第二电离能为3512kJ·mol-1、第三电离能为5495kJ·mol-1,其第二电离能增幅较大的原因是__________________。
(4)某含氨配合物CrCl3·6NH3的化学键类型有配位键、极性共价键和___________。CrCl3·6NH3有三种异构体,按络离子式量增大的顺序分别是[Cr(NH3)6]Cl3、___________、[Cr(NH3)4Cl2]Cl·2NH3。
(5)NH4N3是高能量度材料,其晶胞如下图所示。N3-是直线型结构,N3-中氮原子的杂化类型是___________。在VSEPR模型中NH4+的几何构型名称为______________。
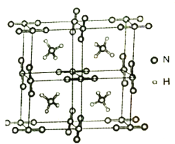
(6)已知NH4N3的晶胞参数为anm和0.5anm,阿伏加德罗常数的值为NA,则NH4N3的密度为_________________g·cm-3。
【答案】2s22p3 0.5NA NA N>O>C O失去1个电子后,2p轨道有3个电子,为半充满状态,较为稳定 离子键 [Cr(NH3)5Cl]Cl2·NH3 sp 正四面体 ![]()
【解析】
=1,NH4+为1个,由此可求出1个小立方体的质量及体积,从而求出NH4N3的密度。
(1)氮原子的电子排布式为1s22s22p3,则基态氮原子的价电子排布式为2s22p3。答案为:2s22p3;
(2)14g氮气为0.5mol,1个氮气分子中含有1个σ键、2个π键,其中以“头碰头”方式形成的共价键为σ键,数目为0.5NA,以“肩并肩”方式形成的共价键为π键,数目为NA。答案为:0.5NA;NA;
(3)C、N、O属于同周期元素且原子序数依次增大,同一周期元素的第一电离能随着原子序数的增大而增大,但N由于2p轨道半充满而出现反常,其第一电离能大于O,所以三种元素按第一电离能从大到小的排列顺序为N>O>C。氧的第二电离能增幅较大,应从2p轨道的电子排布情况进行分析,其原因是O失去1个电子后,2p轨道有3个电子,为半充满状态,较为稳定。答案为:N>O>C;O失去1个电子后,2p轨道有3个电子,为半充满状态,较为稳定;
(4)某含氨配合物CrCl3·6NH3为离子化合物,化学键类型有配位键、极性共价键和离子键。CrCl3·6NH3有三种异构体,按络离子式量增大的顺序分别是[Cr(NH3)6]Cl3、[Cr(NH3)5Cl]Cl2·NH3、[Cr(NH3)4Cl2]Cl·2NH3。答案为:离子键;[Cr(NH3)5Cl]Cl2·NH3;
(5)N3-是直线型结构,其与CO2为等电子体,则N3-中氮原子的杂化类型是sp。在VSEPR模型中NH4+的价层电子对数为4,则几何构型名称为正四面体。答案为:sp;正四面体;
(6)由晶胞结构可知,1个晶胞分为8个小立方体,每个小立方体中,含N3-的个数为8×![]() =1,NH4+为1个,1个小立方体的质量为
=1,NH4+为1个,1个小立方体的质量为![]() g,阿伏加德罗常数的值为NA,则NH4N3的密度为
g,阿伏加德罗常数的值为NA,则NH4N3的密度为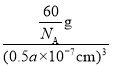 =
= ![]() g·cm-3。答案为:
g·cm-3。答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】我国科技工作者设计了一种电解装置,能将甘油(C3H8O3)和二氧化碳转化为甘油醛(C3H6O3)和合成气,原理如图所示。下列说法错误的是( )
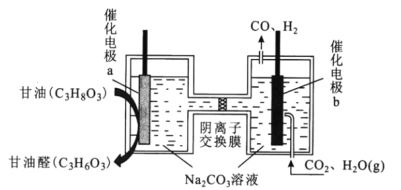
A.催化电极b与电源负极相连
B.电解时催化电极a附近的pH增大
C.电解时阴离子透过交换膜向a极迁移
D.生成的甘油醛与合成气的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的分子酷似企鹅,化学家ChrisScotton将该分子以企鹅来取名为Penguinone。 下列有关Penguinone的说法不正确的是
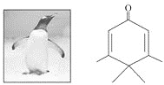
A.Penguinone中存在两种官能团
B.Penguinone是一种芳香酮
C.Penguinone中存在与乙烯相同的官能团,所以其与乙烯有相似的性质
D.如果该分子中的双键都能加成,则1molPenguinone能与3mol氢气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化过程如图所示。下列分析合理的是

A. 催化剂a表面发生了极性共价键的断裂和形成
B. N2与H2反应生成NH3的原子利用率为100%
C. 在催化剂b表面形成氮氧键时,不涉及电子转移
D. 催化剂a、b能提高反应的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个密闭容器中发生如下反应:2SO2(g) + O2(g) ![]() 2SO3(g),反应过程中某一时刻测得SO2、O2、SO3的浓度分别为:0.2 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能出现的数据是( )
2SO3(g),反应过程中某一时刻测得SO2、O2、SO3的浓度分别为:0.2 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能出现的数据是( )
A. c(SO3)=0.4 mol·L-1B. c(SO2)=c(SO3)=0.15 mol·L-1
C. c(SO2)=0.25 mol·L-1D. c(SO2) + c(SO3)=0.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某药物H的一种合成路线如下:
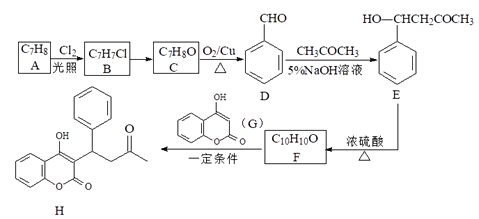
回答下列问题:
(1)C的名称是______________。
(2)F→H的反应类型为______________。B→C的试剂和条件是_____________。
(3)H有多种同分异构体,在下列哪种仪器中可以显示物质中化学键和官能团类型______(填字母)。
A.质谱仪 B.元素分析仪 C.红外光谱仪 D.核磁共振氢谱仪
(4)写出D→E的化学方程式___________。
(5)在E的同分异构体中,同时满足下列条件的结构有____种;其中核磁共振氢谱有六组峰,且峰面积之比为3:3:2:2:1:1的是______。
①既能发生银镜反应,又能发生水解反应;②属于芳香族化合物;③苯环上只有2个取代基。
(6)参照上述流程,以D和乙醛为原料合成![]() (其他无机试剂自选),设计合成路线:____________。
(其他无机试剂自选),设计合成路线:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. BaSO4难溶于水,其属于弱电解质
B. 强电解质的导电能力一定比弱电解质的导电能力强
C. 弱电解质一定是共价化合物
D. H2O能发生微弱电离,是一种弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】漳州市海水资源丰富,漳浦盐场是福建省第三大国有盐场,盐田面积达700万平方米,每年产盐5万多吨。海水化学资源(主要为NaCl和MgSO4及K、Br等元素)的利用具有非常广阔的前景。

回答下列问题:
⑴NaClO3中氯的化合价_____________。
⑵在a、b、c、d提取镁的过程中,没有涉及的化学反应类型是_________(填序号)。
①分解反应 ②化合反应 ③复分解反应 ④置换反应
⑶苦卤中通入氯气发生的主要离子反应方程式为___________________________________。⑷步骤a中的沉淀剂是____________________。
⑸步骤d中,电解熔融MgCl2得到的镁需要在保护气中冷却,下列气体可以作为保护气的是____________(填序号)。
①N2 ②H2 ③CO2 ④空气
⑹假设该海域海水中MgCl2浓度9.5×10-3g·L-1 ,欲获得24g金属镁需要________L海水。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)硅酸盐可以改写成氧化物的形式,将下列硅酸盐改写成氧化物的形式:
①镁橄榄石(Mg2SiO4):____。
②高岭石[Al2(Si2O5)(OH)4]:____。
(2)写出下列反应的方程式:
①漂白粉露置于空气中较长时间后失效的化学方程式: _________________________。
②Cl2通入NaOH溶液中,发生反应的离子方程式:________________________。
③NO2与水反应的化学方程式为___________,该反应中氧化剂与还原剂的物质的量之比为_____________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com