
【题目】(1)硅酸盐可以改写成氧化物的形式,将下列硅酸盐改写成氧化物的形式:
①镁橄榄石(Mg2SiO4):____。
②高岭石[Al2(Si2O5)(OH)4]:____。
(2)写出下列反应的方程式:
①漂白粉露置于空气中较长时间后失效的化学方程式: _________________________。
②Cl2通入NaOH溶液中,发生反应的离子方程式:________________________。
③NO2与水反应的化学方程式为___________,该反应中氧化剂与还原剂的物质的量之比为_____________.
【答案】2MgOSiO2 Al2O32SiO22H2O Ca(ClO)2+CO2+H2O=CaCO)3+2HClO、2HClO![]() 2HCl+O2↑ Cl2+2OH-=Cl-+ClO-+H2O 3NO2+H2O=2HNO3+NO 1:2
2HCl+O2↑ Cl2+2OH-=Cl-+ClO-+H2O 3NO2+H2O=2HNO3+NO 1:2
【解析】
(1)硅酸盐由盐的书写改写为氧化物的一般形式:碱性氧化物、两性氧化物、酸性氧化物、水;
(2)漂白粉露置于空气中首先生成次氯酸,次氯酸见光分解后失效;氯气与NaOH反应生成氯化钠、次氯酸钠和水;NO2与水反应生成NO和硝酸,氧化剂与还原剂的物质的量之比等于还原产物NO与氧化产物HNO3的物质的量之比。
(1)硅酸盐由盐的书写改写为氧化物的一般形式:碱性氧化物、两性氧化物、酸性氧化物、水,注意各种元素化合价不变;
①橄榄石(Mg2SiO4)改写成氧化物形式为:2MgOSiO2;故答案为:2MgOSiO2;
②高岭石[Al2(Si2O5)(OH)4]改写为氧化物形式为:Al2O32SiO22H2O;故答案为:Al2O32SiO22H2O;
(2)①漂白粉露置于空气中失效的化学反应方程式为Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO,2HClO![]() 2HCl+O2↑,故答案为:Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO、2HClO
2HCl+O2↑,故答案为:Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO、2HClO![]() 2HCl+O2↑;
2HCl+O2↑;
②氯气与氢氧化钠反应生成氯化钠、次氯酸与水,反应离子方程式Cl2+2OH-=ClO-+Cl-+H2O,
故答案为:Cl2+2OH-=ClO-+Cl-+H2O;
③NO2与水反应生成NO和硝酸,化学方程式为3NO2+H2O=2HNO3+NO,还原产物NO与氧化产物HNO3的物质的量之比为1:2,因此氧化剂与还原剂的物质的量之比为1:2,故答案为:3NO2+H2O=2HNO3+NO;1:2。


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】氮是极其重要的化学元素。我国科学家最近成功合成了超高含能材料聚合氮和金属氮。基于氮气的能源研究也是未来能源发展的重要方向。
(1)基态氮原子的价电子排布式为___________。
(2)14g氮气分子中原子轨道以“头碰头”方式形成的共价键数目为___________,以“肩并肩”方式形成的共价键数目为___________。
(3)C、N、O三种元素按第一电离能从大到小的排列顺序为___________。已知氧的第一电离能为1369kJ·mol-1、第二电离能为3512kJ·mol-1、第三电离能为5495kJ·mol-1,其第二电离能增幅较大的原因是__________________。
(4)某含氨配合物CrCl3·6NH3的化学键类型有配位键、极性共价键和___________。CrCl3·6NH3有三种异构体,按络离子式量增大的顺序分别是[Cr(NH3)6]Cl3、___________、[Cr(NH3)4Cl2]Cl·2NH3。
(5)NH4N3是高能量度材料,其晶胞如下图所示。N3-是直线型结构,N3-中氮原子的杂化类型是___________。在VSEPR模型中NH4+的几何构型名称为______________。
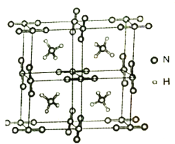
(6)已知NH4N3的晶胞参数为anm和0.5anm,阿伏加德罗常数的值为NA,则NH4N3的密度为_________________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。在如图所示的物质转化关系中,p、q、 m、n分别是元素W、X、Y、Z的气体单质,p和 s均为有色气体,v的水溶液呈碱性。常温下,0.1 mol L -1t 溶液与 0.1 mol L -1 u 溶液的pH均为1。下列说法不正确的是
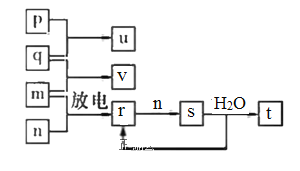
A.Y、W的最高价氧化物对应的水化物均为强酸
B.Z和Y的简单氢化物的稳定性和沸点高低均为:Z>Y
C.s溶于水的反应中,氧化剂与还原剂的物质的量之比为1:2
D.v的电子式可表示为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据已学《物质结构与性质》的有关知识,回答下列问题:
(1)如图所示是元素周期表中第一、第二周期10种元素的某些性质的一组数据(所列数据的单位相同),除带“…”的四种元素外,其余元素都给出了该种元素的全部该类数据。
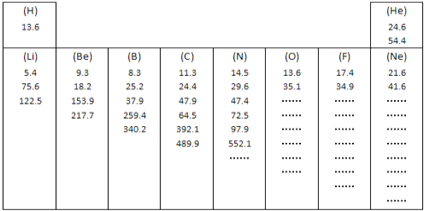
有些元素的逐级电离能中个别地方增大的比例(倍数)特别大,形成“突跃”,由此可以证明原子结构中_______________________的结论。根据这个规律,你认为氧元素8个电离能数据中出现“突跃”的数据应该是第________个。
(2)在①苯 ②CH3OH ③HCHO ④CS2 ⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有_____(填序号),易溶于水的有_____(填序号),理由是:____________。
(3)N≡N键的键能为946kJ·mol-1,N—N键的键能为193kJ·mol-1,则一个π键的平均键能为__________,说明N2中________键更稳定(填“σ”或“π”)。
(4)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续滴加氨水,难溶物溶解,得到深蓝色的透明溶液,写出有关化学反应的离子方程式___________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)分别取W g钠、铁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是________。
(2)分别取0.1 mol钠、铁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是______。
(3)若产生相同物质的量的氢气,反应所需钠、铁、铝的质量比是____________。
(4)若产生相同体积(同温、同压)的氢气,反应所需钠、铁、铝三种金属的物质的量之比是____。
(5)分别取金属钠、铁、铝0.2 mol,分别投入10 mL 1 mol·L-1盐酸中,在标准状况下产生氢气的体积大小的顺序是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)具有强氧化性,在工业上常用作水处理剂、漂白剂。ClO2是一种易溶于水的黄绿色气体,其体积分数超过10%时易引起爆炸。某研究小组欲用以下三种方案制备ClO2,回答下列问题:
(1)以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2,黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42-,写出制备ClO2的离子方程式__。
(2)用过氧化氢作还原剂,在硫酸介质中还原NaClO3制备ClO2,并将制得的ClO2用于处理含CN-废水。实验室模拟该过程的实验装置(夹持装置略)如图所示。

①装置A的名称是__,装置C的作用是__。
②反应容器B应置于30℃左右的水浴中,目的是__。
③通入氮气的主要作用有3个,一是可以起到搅拌作用,二是有利于将ClO2排出,三是__。
④ClO2处理含CN-废水的离子方程式为__,装置E的作用是__。
(3)氯化钠电解法是一种可靠的工业生产ClO2的方法。
①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。某次除杂操作时,往粗盐水中先加入过量的__(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。
②用石墨做电极,在一定条件下电解饱和食盐水制取ClO2,工作原理如图所示,写出阳极产生ClO2的电极反应式__。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列物质中:
①H2O②NH3③NH3H2O④乙醇⑤乙烯⑥CO2⑦CuSO45H2O⑧甲烷⑨H2O2
含非极性键的极性分子有( )
A.①②⑥B.③④⑦C.④⑨D.③④⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高。
(1)若电解质溶液为硫酸,其正极反应式为____________________,负极反应式为___________________;若在常温下转移2mol电子,可产生水质量为_________g。
(2)若用氢氧燃料电池电解由NaCl和CuSO4组成的混合溶液,其中c(Na+)=3c(Cu2+)=3mol·L—1,取该混合液100mL用石墨做电极进行电解,通电一段时间后,在阴极收集到1.12L(标准状况)气体。此时氢氧燃料电池中消耗H2的质量是_______,混合溶液中NaOH的物质的量浓度是__________mol·L-1。
(3)已知可逆反应:AsO43-+2I-+2H+![]() AsO33-+I2+H2O。如图所示,C1棒和C2棒都是石墨电极。
AsO33-+I2+H2O。如图所示,C1棒和C2棒都是石墨电极。
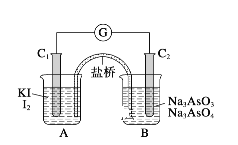
(Ⅰ)若向B中逐滴加入浓盐酸,上述反应向右进行,发现检流计指针向左偏转。
(Ⅱ)若改用向B中滴加40%的NaOH溶液,发现检流计指针与(Ⅰ)中偏转方向相反。
试回答问题:
操作(Ⅰ)中,C1棒上的反应式为_____________________________。
操作(Ⅱ)中,C2棒上的反应式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分:
① | |||||||||||||||||
④ | ⑤ | ⑥ | |||||||||||||||
② | ③ | ⑦ | ⑧ | ||||||||||||||
Fe | |||||||||||||||||
Ⅰ.用化学用语回答下列问题:
(1)①、②、⑥形成的化合物中存在的化学键类型有________。
(2)④、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是_______。
(3)写出②的离子结构示意图为__________。
(4)Y由②⑥⑧三种元素组成,它的水溶液是生活中常见的消毒剂。Y的水溶液与洁厕灵混合使用会产生一种有毒气体,该反应的离子方程式为_______。
Ⅱ.A、B、C、D都是中学化学中常见的物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。根据题意回答下列问题:
![]()
(1)若A是一种金属单质,C是淡黄色固体,写出C的一种用途_____;
(2)若A、B、C均为化合物且含有同一种金属元素,D是会造成温室效应的一种气体,请写出D的电子式_____,A和C反应的离子方程式 ___。
(3)若D是一种常见的过渡金属单质,原子核内有26个质子,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,检验此C溶液中金属离子的方法是________;又知在酸性溶液中该金属离子能被双氧水氧化,写出该反应的离子方程式_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com