
科目:高中化学 来源: 题型:
下列化学物质在实际生产生活和科技等方面的应用不正确的是( )
A.测定NaOH熔点时,可以将NaOH放入石英坩埚中高温加热
B.石英砂可以用于制取高纯度的硅,硅是将太阳能转化为电能的常用材料
C.因为氨易液化,液氨在汽化时会吸收大量的热量,所以液氨可作制冷剂
D.硫酸和硝酸都是重要的工业原料,工业上可用于制化肥、农药和炸药
查看答案和解析>>
科目:高中化学 来源: 题型:
在相同的温度下,体积均为0.25 L的两恒容密闭容器中发生可逆反应:N2(g)+3H2(g)2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始、平衡时的有关数据如表所示,下列叙述错误的是( )
| 起始时各物质的物质 的量(mol) | 达到平衡时能量变化 | |||
| 容器编号 | N2 | H2 | NH3 | |
| ① | 1 | 3 | 0 | 放出23.15 kJ能量 |
| ② | 0.9 | 2.7 | 0.2 | 放出Q kJ能量 |
A.容器①、②中反应的化学平衡常数相等
B.平衡时,两容器中氨气的体积分数均为14.3%
C.反应②达到平衡时,放出的热量Q=23.15 kJ
D.若①的体积为0.5 L,则达到平衡时放出的热量小于23.15 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
臭氧可用于净化空气、饮用水的消毒、处理工业废物和作漂白剂。
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:6Ag(s)+O3(g)===3Ag2O(s) ΔH=-235.8 kJ·mol-1。已知2Ag2O(s)===4Ag(s)+O2(g)
ΔH=+62.2 kJ·mol-1,则常温下反应2O3(g)===3O2(g)的ΔH=________。
(2)配平下面反应的化学方程式(将各物质的化学计量数填在相应的方框内):
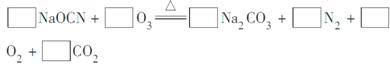
(3)科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,电极反应式为3H2O-6e-===O3↑+6H+,阴极附近溶解在水中的氧气生成过氧化氢,其电极反应式为_______________________。
(4)空气中臭氧的检测方法是将空气慢慢通过足量KI淀粉溶液,若溶液变蓝色,则说明空气中含有O3。已知O3与KI溶液反应生成两种单质,则该反应的离子方程式为_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组微粒,半径大小比较中错误的是 ( )
A.K >Na >Li B.Na+>Mg2+>Al3+ C.Cl—>F—>F D.Mg2+>Na+>F—
查看答案和解析>>
科目:高中化学 来源: 题型:
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是 ( )
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.用硝酸铜溶液代替硫酸铜溶液进行实验,不能观察到同样的现象
C.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]
D.在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道
查看答案和解析>>
科目:高中化学 来源: 题型:
(1) 已知:0.4 mol液态肼(N2H4)与足量的液态双氧水反应,生成氮气和水蒸气,放出256.65 kJ的热量.
①反应的热化学方程式为:____________________________________________.
②此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是______________________________________________________________.
(2)丙烷燃烧可以通过以下两种途径:
途径Ⅰ:C3H8(g)+5O2(g)===3CO2(g)+4H2O(l) ΔH=-a kJ/mol
途径Ⅱ:C3H8(g)===C3H6(g)+H2(g) ΔH=+b kJ/mol
2C3H6(g)+9O2(g)===6CO2(g)+6H2O(l) ΔH=-c kJ/mol
2H2(g)+O2(g)===2H2O(l) ΔH=-d kJ/mol
请回答下列问题:
①等量的丙烷通过两种途径放出的热量,途径Ⅰ放出的热量________(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量.
②C3H8(g)===C3H6(g)+H2(g)的反应中,反应物具有的总能量________(填“大于”、“等于”或“小于”)生成物具有的总能量,.
③b与a、c、d的数学关系式是_____________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.1mol的镁、铝混合物溶于100ml 4mol/L的盐酸中,然后滴加NaOH溶液,在滴加NaOH溶液过程中,沉淀的质量m随加入NaOH溶液的体积V变化的关系如图所示。

(1)请写出每个阶段发生反应的离子方程式:
OV1段:
V1V2段:
V2V3段:
(2)在滴加NaOH的过程中,若V2=400ml,则加入NaOH溶液的浓度为 mol/L。
(3)滴加上述浓度的NaOH时,若V1=160ml,则金属粉末中n(Mg)= mol,
n(Al)= mol, V3= ml。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com