
| c(H+) |
| c(CH3COOH) |
| A.加少量烧碱固体 | B.升高温度 |
| C.加少量冰醋酸 | D.加CH3COONa |
科目:高中化学 来源:不详 题型:单选题
| A.0.325V<w<32.5n |
| B.产生H2的平均反应速率盐酸大于醋酸 |
| C.产生H2的量盐酸多于醋酸 |
| D.与醋酸反应时锌有剩余 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.V2=10V1 | B.V1>10V2 | C.V2<10V1 | D.V2>10V1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶液的pH减小 | B.NH3?H2O电离程度变大 |
| C.溶液的导电能力减弱 | D.溶液中c(H+)减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.②③ | C.③④ | D.②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| c(OH-) |
| c(H+) |
| A.该一元酸溶液的pH=1 | ||
| B.该溶液中HA的电离度为1% | ||
| C.该溶液中水的离子积常数为1×10-22 | ||
D.若加水稀释,则
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.弱电解质的相对强弱可由相同温度下的电离常数值的大小来判断 |
| B.同一弱电解质,浓度越大,电离程度越大 |
| C.升高温度,弱电解质的电离程度减小 |
| D.通常,电解质越弱,则其溶液的导电能力就越差 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| c(OH-) |
| c(NH3?H2O) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
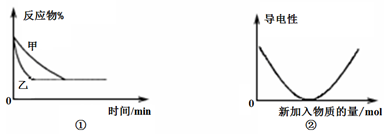
A.图①可表示温度对“A2(g) + 3B2(g) 2AB3(g)△H<0”的影响 2AB3(g)△H<0”的影响 |
B.图①可表示压强对2A(g) + 2B(g) 3C(g) +D(s)的影响 3C(g) +D(s)的影响 |
| C.图②可表示醋酸溶液中通入氨气至过量,溶液导电性的变化 |
| D.图②可表示Ba(OH)2溶液中滴加稀硫酸,溶液导电性的变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com