
【题目】如果定义有机物的同系物是一系列结构式符合 ![]() (其中n=0、1、2、3…)的化合物。式中A、B是任意一种基团(或氢原子),W为2价有机基团,又称为该同系列的系差。同系列化合物的性质往往呈现规律变化。下列四组化合物中,不可称为同系列的是
(其中n=0、1、2、3…)的化合物。式中A、B是任意一种基团(或氢原子),W为2价有机基团,又称为该同系列的系差。同系列化合物的性质往往呈现规律变化。下列四组化合物中,不可称为同系列的是
A. CH3CH2CH2CH3、CH3CH2CH2CH2CH3
B. CH3CH=CHCHO、CH3CH=CHCH=CHCHO、CH3(CH=CH)3CHO
C. CH3CHClCH3、CH3CHClCH2CH3、CH3CHClCH2CHClCH3
D. ClCH2CHClCCl3、ClCH2CHClCH2CHClCCl3、ClCH2CHClCH2CHClCH2CHClCCl3
科目:高中化学 来源: 题型:
【题目】还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
![]()
已知转化过程中的反应为2CrO42-(aq)+2H+(aq)![]() Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
A. 溶液颜色保持不变,说明上述可逆反应达到平衡状态
B. 若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,至少需要458.7g
C. 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5
D. 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。在不同温度时K1、K2的值如下表:
FeO(s)+H2(g)的平衡常数为K2。在不同温度时K1、K2的值如下表:
温度(绝对温度) | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
(1)计算温度为973K时,反应CO2(g)+H2(g)![]() CO(g)+H2O(g) K=__________;
CO(g)+H2O(g) K=__________;
(2)目前工业上有一种方法是用CO2来生产甲醇:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2进行反应。
CH3OH(g)+H2O(g),在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2进行反应。
①该反应能够自发进行的原因是________。
②下列措施中能使c(CH3OH)增大的是________。
A.降低温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来
D.再充入1 mol CO2和3 mol H2
③在温度T1时,当反应达到平衡时,测得n(H2)=2.4 mol;其他条件不变,在温度T2时,当反应达到平衡时,测得n(CO2)=0.82 mol,则T2________T1(填“>”、“<”或“=”)。
(3)某实验将一定量的CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:CO2(g) +3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。测得CH3OH的物质的量随时间变化如下图所示,回答问题:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。测得CH3OH的物质的量随时间变化如下图所示,回答问题:

①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ________KⅡ(填“>”、“<”或“=”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物 投入量 | 1 mol CO2、3 mol H2 | a mol CO2、b mol H2、 c mol CH3OH(g)、c mol H2O(g) |
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中相同组分的浓度相等,且起始时维持反应逆向进行,则c的取值范围为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们从蛋白质水解产物中分离出一种含有1个氮原子的氨基酸进行分析时,从0.19g该氨基酸得16mL的氮气(在标准状况下),试计算该氨基酸的含氮量和式量,假如19.95g该氨基酸可以和100mL1.5mol/L的Ba(OH)2溶液恰好完全反应,试推出该氨基酸的结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体。根据下图关系推断:

(1)写出化学式:X_______,A________,B_______。
(2)实验室收集气体D和F的方法依次是_______法、________法。
(3)写出C→E的化学方程式:____________。
(4)请写出A与E反应生成D的化学方程式:_______________
(5)检验物质A的方法和现象是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳正离子[例如,CH3+,CH5+,(CH3)3C+等]是有机反应中重要的中间体。欧拉(G.Olah)因在此领域研究中的卓越成就而荣获1994年诺贝尔化学奖。碳正离子CH5+可以通过CH4在“超强酸”中再获得一个H+而得到,而CH5+失去H2可得CH3+。
(1)CH3+ 是反应性很强的正离子,是缺电子的,其电子式是__________________。
(2)CH3+ 中4个原子是共平面的,三个键角相等,键角应是_________(填角度)。
(3)(CH3)2CH+ 在NaOH的水溶液中反应将得到电中性的有机分子,其结构简式是_____________。
(4)(CH3)3C+ 去掉H+ 后将生成电中性的有机分子,其结构简式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述中正确的是
4NO(g)+6H2O(g),下列叙述中正确的是
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率增大
D. 化学反应速率的关系是2v逆(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、E为家庭中常见有机化合物,A与高锰酸钾酸性溶液反应可生成B,D是石油化工发展水平的标志,E是一种常见的高分子材料。根据下面的转化关系回答下列问题:
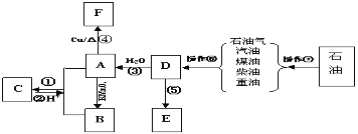
(1)D的结构简式为:_____________。
(2)B中官能团的名称为:______________。
(3)在①~⑤中属于氧化反应的是_________;属于加成反应的是________。(填序号)
(4)写出下列反应方程式:反应①________________________;
反应④_________________________。
(5)用A、B制备物质C时,除去C中含有的杂质选择的试剂及操作分别为___________,___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com