
【题目】a mol H2和b mol C2H2在密闭容器中反应,当其达到平衡时,生成c mol C2H4,将平衡混合气体完全燃烧生成CO2和H2O,所需氧气的物质的量为
A. (![]() )mol B. (a+3b)mol
)mol B. (a+3b)mol
C. (![]() )mol D. (a+3b+2c)mol
)mol D. (a+3b+2c)mol
【答案】A
【解析】
根据元素守恒,反应后混合气体的耗氧量即是amolH2和bmolC2H2的耗氧量,反应生成CO2和H2O,根据碳元素守恒有n(CO2)=2n(C2H2),根据氢元素守恒由n(H2O)=n(C2H2)+n(H2),根据氧元素守恒有2n(O2)=2n(CO2)+n(H2O),据此计算消耗的氧气。
根据元素守恒,反应后混合气体的耗氧量即是amolH2和bmolC2H2的耗氧量,根据碳元素守恒有n(CO2)=2n(C2H2)=2bmol,根据氢元素守恒由n(H2O)= =n(C2H2)+n(H2)=bmol+amol,根据氧元素守恒有2n(O2)=2n(CO2)+n(H2O)=2×2bmol+bmol+amol=5bmol+amol,即n(O2)=![]() mol,故合理选项是A。
mol,故合理选项是A。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D 原子序数依次增加,X、Y、Z、W是由这四种元素中的两种元素组成的常见化合物,X为有刺激性气味的气体,Y为淡黄色固体,甲是由C元素形成的气体单质,乙为红棕色气体,上述物质之间的转化关系如下图所示(部分反应物或生成物省略)。下列说法正确的是

A. 原子半径大小顺序:D>C>B>A B. 最简单气态氢化物的稳定性:B>C
C. 图示转化关系涉及的反应均为氧化还原反应 D. 元素C、D形成的化合物中一定只含离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同体积、相同pH的某一元强酸溶液①和某一元中强酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是( )

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K、Ka、KW分别表示化学平衡常数、电离常数和水的离子积常数,下列判断正确的是( )
A. 在500℃、20 MPa条件下,在5 L密闭容器中进行合成氨的反应,使用催化剂后K增大
B. 室温下Ka(HCN) < Ka(CH3COOH),说明CH3COOH电离产生的c(H+)一定比HCN电离产生的c(H+)大
C. 25℃时,pH均为4的盐酸和NH4I溶液中KW不相等
D. 2SO2+O2![]() 2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当温度高于 500 K 时,科学家成功利用二氧化碳和氢气合成了乙醇,这在节能减排、降低碳排放方面具有重大意义。
(1)该反应的化学方程式为________________;其平衡常数表达式为K=________。
(2)在恒容密闭容器中,判断上述反应达到平衡状态的依据是________。
a.体系压强不再改变 b.H2的浓度不再改变 c.气体的密度不随时间改变 d.单位时间内消耗 H2和 CO2的物质的量之比为 3∶1
(3)已知:1 g 氢气完全燃烧生成液态水,放出 143 kJ 热量;23 g 乙醇完全燃烧生成液态水和二氧化碳,放出 650 kJ 热量,则氢气和乙醇的燃烧热的比值为________。(要求计算出数值)
(4)在一定压强下,测得由 CO2制取 CH3CH2OH 的实验数据中,起始投料比、温度与 CO2的转化率的关系如图所示,根据图中数据

①降低温度,平衡向________方向移动。
②在 700 K、起始投料比 n(H2)/n(CO2)=1.5 时,H2的转化率为________。
③在 500 K、起始投料比n(H2)/n(CO2)=2 时, 达到平衡后 H2的浓度为a mol·L-1,则达到平衡时 CH3CH2OH 的浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用下列装置,进行与氯气相关的实验。
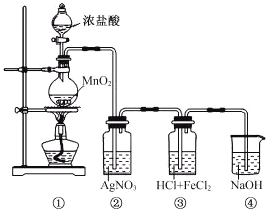
(1)装置④中NaOH溶液的作用是___________。
(2)实验结束后,取装置③中的溶液,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到FeCl3·6H2O晶体。在蒸发浓缩操作中,不需要的仪器是___________。
A.蒸发皿 B.漏斗 C.玻璃棒 D.酒精灯
(3)装置②中出现白色沉淀,据此现象能否推测装置①中生成Cl2___________________,请说明理由_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、H3AsO3和H3AsO4水溶液中含砷的各种微粒的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图所示。

(1)以酚酞为指示剂(变色范围pH8.0 ~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为______。
(2)pH=11时,图中H3AsO3水溶液中三种微粒浓度由大到小顺序为______;
(3)H3AsO4第一步电离方程式为______;
(4)若pKa2=-1gHKa2,H3AsO4第二步电离的电离常数为Ka2,则pKa2=______。
Ⅱ、用0.1000molL-1AgNO3滴定50.00mLL-3Cl-溶液的滴定曲线如图所示

(5)根据曲线数据计算可知Ksp(AgCl)数量级为______;
(6)相同实验条件下,若改为0.0400molL-1Cl-,反应终点c移到______;(填“a”、“b”或“d”)
(7)已知Ksp(AgCl)>Ksp(AgBr),相同实验条件下,若给为0.0500molL-1Br-,反应终点c向______方向移动(填“a”、“b”或“d”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)FeCl3的水溶液呈______(填“酸”、“中”、“碱”)性,原因是:________________________(用离子方程式表示);实验室在配制FeCl3的溶液时,常将FeCl3固体先溶于盐酸中,然后再用蒸馏水稀释到所需的浓度,以______(填“促进”、“抑制”)其水解;将FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是______。
(2)测NaClO溶液的pH,可用__________________(填“广泛pH试纸”、“精密pH试纸”、“pH计”);NaClO溶液显碱性的原因是:________________________(用离子方程式表示);已知HClO的Ka=2.95×10-8,碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,则NaClO溶液中通入少量的CO2,所发生的化学方程式为__________。
II.已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系
A.c(Cl-)>c (NH4+)>c (H+)>c(OH-)
B.c (Cl-)>c (NH4+)>c (OH-)>c (H+)
C.c(NH4+)>c (Cl-)>c(OH-)>c (H+)
D.c (Cl-)>c (H+)>c (NH4+)>c (OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,该溶质是_______,上述四种离子浓度的大小顺序为____________(填序号);
(2)若上述关系中C是正确的,则溶质为___________________;若上述关系中D是正确的,则溶质为___________________。
(3)若该溶液是体积相等的浓盐酸和氨水混合而成,且恰好是中性,则混合前c(HCl) _______ c (NH3H2O)(大于、小于或等于)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷精矿湿法制备磷酸的一种工艺流程如下:

已知:磷精矿主要成分为Ca5(PO4)3(OH),还含有Ca5(PO4)3F和有机碳等。
溶解度:Ca5(PO4)3(OH)<CaSO4·0.5H2O
(1)上述流程中能加快反应速率的措施有__________。
(2)磷精矿粉酸浸时发生反应:
2Ca5(PO4)3(OH)+3H2O+10H2SO4![]() 10CaSO4·0.5H2O+6H3PO4
10CaSO4·0.5H2O+6H3PO4
①该反应体现出酸性关系:H3PO4__________H2SO4(填“>”或“<”)。
②结合元素周期律解释①中结论:P和S电子层数相同,__________。
(3)酸浸时,磷精矿中Ca5(PO4)3F所含氟转化为HF,并进一步转化为SiF4除去。写出生成HF的化学方程式:__________。
(4)H2O2将粗磷酸中的有机碳氧化为CO2脱除,同时自身也会发生分解。相同投料比、相同反应时间,不同温度下的有机碳脱除率如图所示。80℃后脱除率变化的原因:____________________。

(5)脱硫时,CaCO3稍过量,充分反应后仍有SO42残留,原因是__________;加入BaCO3可进一步提高硫的脱除率,其离子方程式是____________________。
(6)取a g所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用b mol·L1NaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液c mL,精制磷酸中H3PO4的质量分数是________。(已知:H3PO4摩尔质量为98 g·mol1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com