
【题目】氯化硫酰(SO2Cl2)主要用作氯化剂.它是一种无色液体,熔点﹣54.1℃,沸点69.1℃.氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:
SO2(g)+Cl2(g)SO2Cl2(l)△H=﹣97.3kJ/mol
(1)试写出常温常压下化学平衡常数K的表达式:K=;若在此条件下,将化学平衡常数K增大,化学反应速率v正也增大,可采取的措施是(选填编号).
a.降低温度 b.移走SO2Cl2 c.增加反应物浓度 d.以上都不对
(2)为了提高上述反应中Cl2的平衡转化率,下列措施合理的是(选填编号).
a.缩小容器体积 b.使用催化剂c.增加SO2浓度 d.升高温度
(3)在100℃时,往上述平衡体系中加入37Cl2 , 一段时间后,则平衡体系中含有37Cl的物质有(选填编号).
a.只有37Cl2 b.只有SO ![]() Cl2 c.37Cl2和SO
Cl2 c.37Cl2和SO ![]() Cl2 d.无法判断
Cl2 d.无法判断
(4)下列描述中能说明上述反应已达平衡的是(选填编号).
a.v(Cl2)=v(SO2)
b.容器中气体压强不随时间而变化
c.c(Cl2):c(SO2)=1:1
d.容器中气体颜色不随时间而变化.
【答案】
(1)![]() ;d
;d
(2)ac
(3)c
(4)bd
【解析】解:(1)常温常压下SO2(g)+Cl2(g)SO2Cl2(l)的平衡常数K= ![]() ,平衡常数只受温度影响,将化学平衡常数K增大,应使平衡向正反应移动,该反应正反应是放热反应,故应降低温度,化学反应速率降低,故不能实现K增大的同时化学反应速率v正增大,故选d,
,平衡常数只受温度影响,将化学平衡常数K增大,应使平衡向正反应移动,该反应正反应是放热反应,故应降低温度,化学反应速率降低,故不能实现K增大的同时化学反应速率v正增大,故选d,
所以答案是: ![]() ;d;(2)提高反应中Cl2的平衡转化率,改变条件使平衡向正反应移动,不能只增大氯气的用量,
;d;(2)提高反应中Cl2的平衡转化率,改变条件使平衡向正反应移动,不能只增大氯气的用量,
a.缩小容器体积,压强增大,平衡向正反应移动,Cl2的转化率增大,故a正确;
b.使用催化剂,缩短到达平衡的时间,不影响平衡移动,Cl2的转化率不变,故b错误;
c.增加SO2浓度,平衡向正反应移动,Cl2的转化率增大,故c正确;
d.该反应正反应是放热反应,升高温度,平衡向逆反应移动,Cl2的转化率降低,故d错误;
所以答案是:ac;(3)增大氯气的浓度,平衡向正反应移动,反应为可逆反应,氯气不能完全反应,故平衡时37Cl存在37Cl2和SO237Cl2 中,
所以答案是:c;(4)a.υ(Cl2)=υ(SO2),没有指明正、逆速率,无法判断,故a错误;
b.随反应进行,气体的物质的量减小,压强减小,容器中气体压强不随时间而变化,说明达到平衡,故b正确;
c.平衡时氯气与二氧化硫的浓度与起始浓度有关,起始浓度不同,平衡时二者浓度不同,若二者起始浓度相同,用于二者按1:1反应,故任意时刻二者的浓度都相同,故c(Cl2):c(SO2)=1:1不能说明达到平衡,故c错误;
d.容器中气体颜色不随时间两变化,说明氯气的浓度不再变化,说明达到平衡,故d正确;
所以答案是:bd.
【考点精析】解答此题的关键在于理解化学平衡状态本质及特征的相关知识,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效),以及对化学平衡状态的判断的理解,了解状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】除去苯中所含的苯酚,可采用的适宜方法是( )
A.加70℃以上的热水,分液
B.加适量浓溴水,过滤
C.加足量NaOH溶液,分液
D.加适量FeCl3溶液,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于加成反应的是( )
A.乙烯使酸性KMnO4溶液褪色
B.将苯滴入溴水中,振荡后水层接近无色
C.乙烯使溴的四氯化碳溶液褪色
D.甲烷与氯气混合,光照一段时间后黄绿色消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.实验室可用KMnO4和浓盐酸反应制取氯气。
2KMnO4+16HCl(浓) ![]() 2KCl+2MnCl2+5Cl2↑+8H2O
2KCl+2MnCl2+5Cl2↑+8H2O
(1)用单线桥标出电子转移的方向和数目。____________________
(2)将上述配平的化学方程式改写为离子方程式__________________________________ 。
(3)浓盐酸在反应中显示出来的性质是________________
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(4)若产生0.5molCl2,则被氧化的HCl________mol,转移的电子的数目约为____________。
II.根据反应Cu+4HNO3(浓)![]() Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
①还原产物是______。
②氧化剂与氧化产物的物质的量之比是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH、FeCl3、AlCl3三种固体组成的混合物溶于足量水后,产生1.07g沉淀,再向所得悬浊液中逐滴加入1mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.

试回答:
(1)A点沉淀为______,(填化学式)B点沉淀为________.(填化学式)
(2)原固体混合物中各物质的物质的量分别是多少?___________
(3)C点处的盐酸的体积是多少毫升? ____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mLBaCl2、AlCl3、FeCl3 的混合溶液A中逐滴加入Na2SO4和NaOH的混合溶液B,产生沉淀的物质的量n和加入溶液B的体积关系如图所示: 
(1)当加入110mLB溶液时,溶液中的沉淀是(填化学式).
(2)溶液B中Na2SO4和NaOH的物质的量浓度之比是 . 当B溶液加到90mL~100mL这一段时间中,所发生的离子反应方程式是
(3)将A、B溶液中各溶质的物质的量浓度(c)填入下表中.
溶质 | Na2SO4 | NaOH | BaCl2 | AlCl3 | FeCl3 |
c/molL﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019 年 12 月 27 日晚,长征五号运载火箭“胖五”在海南文昌航天发射场成功将实践二十号卫星送入预定轨道。下列有关说法正确的是
A.胖五”利用液氧和煤油为燃料,煤油为纯净物
B.火箭燃料燃烧时将化学能转化为热能
C.火箭箭体采用铝合金是为了美观耐用
D.卫星计算机芯片使用高纯度的二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关气体摩尔体积的描述中正确的是( )
A. 气体摩尔体积的数值是固定不变的,都约为22.4L
B. 通常状况下的气体摩尔体积约为22.4L
C. 标准状况下的气体的摩尔体积约为22.4L
D. 标准状况下,气体的摩尔体积约为22.4L/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物A经李比希法测得其中含碳为70.59%,含氢为 5.88%,其余含有氧.现用下列方法测定该有机化合物的相对分子质量和分子结构.
方法一:用质谱法分析得知A的质谱图如下: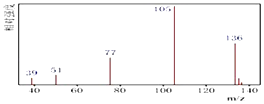
方法二:核磁共振仪测出A的核磁共振氢谱有4个峰,其面积之比为1:2:2:3,如图A.
方法三:利用红外光谱仪测得A分子的红外光谱,如图B.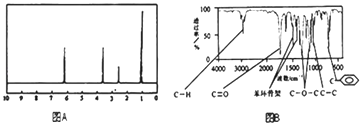
(1)A的分子式为
(2)该物质属于哪一类有机物 .
(3)A的分子中只含一个甲基的依据是(填序号).
a.A的相对分子质量 b.A的分子式
c.A的核磁共振氢谱图 d.A分子的红外光谱图
(4)A的结构简式为 .
(5)A的芳香类同分异构体有多种,其中又同时符合下列条件:①属于酯类;②分子结构中含有一个甲基.则该芳香类A的同分异构体共有种.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com