
【题目】海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料。图是海水综合利用的部分流程图,据图回答问题:

(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式) ________________________。
(2)结合题目信息,写出电解饱和食盐水的化学反应方程式为 ___________________________ 。
(3)苦卤中通入Cl2已经置换出Br2,为什么吹出后用SO2吸收转化为Br-再用Cl2置换 ,SO2的作用是______,由此判断Cl2、Br2、SO2的氧化性由强到弱的顺序为 _____________________。
(4)也有工艺是在吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出.该反应的离子方程式是 __________________________________ ;最后再用H2SO4处理得到Br2,之后加入CCl4进行Br2的萃取,混合溶液用 __________ 分离。
【答案】BaCl2、NaOH、Na2CO3、HCl 2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH 第一次吹出的Br2浓度太低,分离浪费原料,SO2吸收主要起到富集作用 Cl2>Br2>SO2 3Br2+3CO32-═5Br-+BrO-3+3CO2↑ 分液漏斗
Cl2↑+H2↑+2NaOH 第一次吹出的Br2浓度太低,分离浪费原料,SO2吸收主要起到富集作用 Cl2>Br2>SO2 3Br2+3CO32-═5Br-+BrO-3+3CO2↑ 分液漏斗
【解析】
(1)根据除杂原则结合离子的性质分析判断。
(2)电解饱和食盐水生成NaOH、H2和Cl2。
(3)根据“同一氧化还原反应中,氧化性:氧化剂>氧化产物”比较氧化性强弱。
(4)根据原子守恒书写Br2与Na2CO3溶液反应的化学方程式;根据物质的性质差异选择分离的方法。
(1)除去Ca2+用Na2CO3、除去Mg2+用NaOH、除去SO42-用BaCl2;为了使杂质完全除去,所加除杂试剂必须过量,过量的除杂试剂成为新杂质,所以Na2CO3还用于除去过量的BaCl2,Na2CO3溶液必须在BaCl2溶液之后加入;过滤后加入稀盐酸除去过量的NaOH和Na2CO3;所加试剂及先后顺序为BaCl2、NaOH、Na2CO3、HCl(或NaOH、BaCl2、Na2CO3、HCl)。
(2)电解饱和食盐水生成NaOH、H2和Cl2,反应的化学方程式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。
(3)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收,涉及的反应有Cl2+2Br-=2Cl-+Br2、Br2+SO2+2H2O=H2SO4+2HBr,用SO2吸收Br2的离子方程式为Br2+SO2+2H2O=4H++SO42-+2Br-,由于第一次吹出的Br2浓度太低,分离浪费原料,因此SO2吸收主要起到富集作用反应;“Cl2+2Br-=2Cl-+Br2”中氧化剂为Cl2,氧化产物为Br2,同一氧化还原反应中,氧化性:氧化剂>氧化产物,则氧化性:Cl2>Br2;反应“Br2+SO2+2H2O=H2SO4+2HBr”中氧化剂为Br2,SO2为还原剂,氧化性:Br2>SO2;则Cl2、Br2、SO2的氧化性由强到弱的顺序为Cl2>Br2>SO2。
(4)吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出,Br2与Na2CO3溶液反应的化学方程式为3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑,反应的离子方程式为3Br2+3CO32-=5Br-+BrO3-+3CO2↑。加入H2SO4处理得到Br2的化学方程式为5NaBr+NaBrO3+3H2SO4=3Na2SO4+3Br2+3H2O,加入CCl4进行Br2的萃取得到Br2的四氯化碳溶液,因此混合溶液用分液漏斗分离。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】能用渗析分离方法提纯的物质组是
A. 硝酸银与碘化钾等物质的量反应后的混合物
B. 淀粉与碘化银的混合物
C. 蛋白质与葡萄糖的混合溶液
D. 盐卤和明矾的混合溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Zn-MnO2干电池广泛应用,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是_____。电池工作时,电流流向___________(填“正极”或“负极”)
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀。请解释原因_________。欲除去Cu2+,最好选用下列试剂中的(填代号)。
A.NaOH B. Zn C. Fe D. NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阳极反应式为________。若电路中通过2 mole-,MnO2的理论产量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1200℃时,天然气脱硫工艺中会发生下列反应
①H2S(g)+3/2O2(g)=SO2(g)+H2O(g)△H1
②2H2S(g)+SO2(g)=3/2S2(g)+2H2O(g)△H2
③H2S(g)+1/2O2(g)=S(g)+H2O(g)△H3
④2S(g)=S2(g)△H4
则△H4的正确表达式为( )
A. △H4=![]() (△H1+△H2-3△H3)B. △H4=
(△H1+△H2-3△H3)B. △H4=![]() (3△H3-△H1-△H2)
(3△H3-△H1-△H2)
C. △H4=![]() (△H1+△H2-3△H3)D. △H4=
(△H1+△H2-3△H3)D. △H4=![]() (△H1-△H2-3△H3)
(△H1-△H2-3△H3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)键线式![]() 表示的分子式____________名称是_______
表示的分子式____________名称是_______
(2) 中含有的官能团的名称为_______
中含有的官能团的名称为_______
(3)戊烷的某种同分异构体只有一种一氯代物,试书写它的结构简式______
(4)某炔烃和氢气充分加成生成2,5-二甲基己烷,该炔烃的结构简式是____________
(5)某芳香烃结构为![]() 。它的分子式为________,一氯代物有________种。
。它的分子式为________,一氯代物有________种。
(6)分子式为C6H12的某烃的所有碳原子都在同一平面上,则该烃的结构简式为_________,若分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为__________。
(7)分子式为C8H10的芳香烃,苯环上的一氯代物只有一种,该芳香烃的结构简式是______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]硼及其化合物用途非常广泛,回答下列问题。
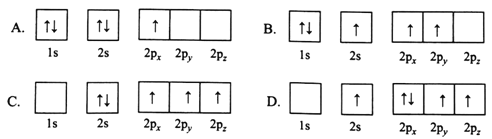
(1)下列B原子电子排布图表示的状态中,能量最低和最高的分别为________、________(填标号)
(2)H3BO3是一元弱酸,可用作医用消毒剂其水溶液呈酸性的原理为:
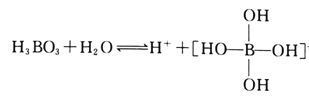
则1mol硼酸分子中含有的共用电子对数为________个。
(3)BF3可用于制造火箭的高能燃料,其分子的空间构型是________________,硼原子杂化方式是________________;BF3能与乙醚发生反应:(C2H5)2O+BF3→BF3·O(C2H5)2,该反应能发生,其原因是________________________________。
(4)硼的一种化合物结构简式为O=B—CH=C=CH2,该分子中含________个σ键。
(5)下图中图(a)为类似石墨的六方BN,图(b)为立方BN。
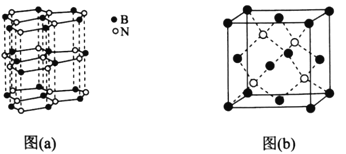
①六方BN具有良好的润滑性,是因为________________________;六方BN不能像石墨一样具有导电性,其原因是________________________。
②已知立方BN的晶胞参数为0.3615nm,阿伏加德罗常数的值为NA,则立方BN的密度为________________g·cm-3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 在标准状况下.11.2L丙烷含有的极性键数目为5NA
B. 7g锂在空气中完全燃烧时转移的电子数为NA
C. 1mol葡萄糖(C6H12O6)分子含有的羟基数目为6NA
D. 常温下,0.2L0.5mol/LNH4NO3溶液中含有的氮原子数小于0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.CaO与水反应过程中,有共价键的断裂和形成
B.H2O的热稳定性比H2S强,是由于H2O的分子间作用力较大
C.KCl、HCl、KOH的水溶液都能导电,所以它们都属于离子化合物
D.葡萄糖(C6H12O6)、二氧化碳和足球烯(C60)都是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒压下,向密闭容器中充入4molSO2和2molO2,发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量QkJ,则下列分析正确的是
2SO3(g) ΔH<0。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量QkJ,则下列分析正确的是
A. 在该条件下,反应前后的压强之比为6∶5.3
B. 若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)>1.4mol
C. 若反应开始时容器容积为2L,则v(SO3)=0.35mol·L-1·min-1
D. 若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量小于Q kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com