
【题目】在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10﹣5 |
下列说法不正确的是( )
A.上述生成Ni(CO)4(g)的反应为放热反应
B.25℃时反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数为2×10﹣5
C.80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2 mol/L
D.在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol/L,则此时v(正)>v(逆)
【答案】D
【解析】A.由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,故正反应为放热反应,故A不符合题意;
B.25°C时反应Ni(s)+4CO(g)Ni(CO)4(g)的平衡常数为5×104,相同温度下,对于同一可逆反应的正、逆反应平衡常数互为倒数,故25°C时反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数为 ![]() =2×10﹣5,故B不符合题意;
=2×10﹣5,故B不符合题意;
C.80°C达到平衡时,测得n(CO)=0.3mol,c(CO)= ![]() =1mol/L,故c[Ni(CO)4]=Kc4(CO)=2×14mol/L=2mol/L,故C不符合题意;
=1mol/L,故c[Ni(CO)4]=Kc4(CO)=2×14mol/L=2mol/L,故C不符合题意;
D.浓度商Qc= ![]() =8,大于80°C平衡常数2,故反应进行方向逆反应进行,故v(正)<v(逆),故D符合题意;
=8,大于80°C平衡常数2,故反应进行方向逆反应进行,故v(正)<v(逆),故D符合题意;
所以答案是:D.
【考点精析】根据题目的已知条件,利用化学平衡的计算的相关知识可以得到问题的答案,需要掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】微量元素是指每种质量不到体重的万分之一,质量总和不到人体质量的千分之一的近二十种元素,这些元素对人体正常代谢和健康起着重要作用.下列元素不是微量元素的是( )
A.I
B.H
C.Zn
D.Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】许多物质与身体健康有着密切关系,请结合所学知识,判断下列叙述中错误的是( )
A.缺镁易患心血管病,缺碘易患甲状腺肿大
B.在医疗上FeCl3常用作止血剂,ZnSO4常用作收敛剂
C.葡萄糖、食盐、味精均可作食品添加剂
D.苏丹红是一种呈红色的有机物,能当作辣椒红色素用于食品加工
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行下列实验:
装置 | 操作 | 现象 |
| 将盛有浓硝酸的烧杯A放入盛有淀粉KI溶液的烧杯C中,然后将铜片放入烧杯A后,立即用烧杯B罩住 | 烧杯A液体上方立即出现大量红棕色气体;一段时间后,红棕色气体消失,烧杯A和C中的液体都变成蓝色 |
下列说法合理的是
A.烧杯A中发生反应:3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O
B.红棕色气体消失只与NO2和烧杯C中的KI发生反应有关
C.烧杯C中溶液变蓝只与NO2和C中溶液发生反应有关
D.若将铜片换成铁片,则C中的液体也可能变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)是印染工业的一种常用原料,连二亚硫酸钠又称保险粉,可溶于水,但不溶于甲醇,其固体受热、遇水都会发生反应放出大量的热,甚至引起燃烧,工业制备流程如下:

请回答下列问题:
(1)保存连二亚硫酸钠的注意事项_____________________(任写一项)。
(2)向液锌中鼓入M气体,使液态锌雾化,目的是___________________;鼓入的气体M为空气的一种主要成分,则M的电子式为________________;
(3)流程②的化学方程式为________________________________________________。
(4)流程③的分离方法步骤为过滤、洗涤、干燥。其中过滤用到的玻璃仪器除烧杯、玻璃棒外还有________;洗涤所用试剂是_______;实验时加入NaCl固体的作用是____________________________。
(5)连二亚硫酸钠可以用于除去废水中的重铬酸根离子(Cr2O72-被转化为Cr3+,S2O42-被转化为SO42-),写出该反应的离子方程式__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.只含有共价键的物质属于共价化合物
B.吸热反应不一定需要加热才能发生
C.含有离子键的物质肯定含金属元素
D.所有物质中均含有化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
实验操作和现象:
操作 | 现象 |
关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 |
打开弹簧夹,通入N2,停止加热,一段时间后关闭 |
|
从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
(1)A中反应的化学方程式是 。
(2)C中白色沉淀是 ,该沉淀的生成表明SO2具有 性。
(3)C中液面上方生成浅棕色气体的化学方程式是 。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
①为证实各自的观点,在原实验基础上:
甲在原有操作之前增加一步操作,该操作是 ;
乙在A、B间增加洗气瓶D,D中盛放的试剂是 。
②进行实验,B中现象:
甲 | 大量白色沉淀 |
乙 | 少量白色沉淀 |
检验白色沉淀,发现均不溶于稀盐酸。结合离子方程式解释实验现象异同的原因: 。
(5)合并(4)中两同学的方案进行实验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些化学问题可用相似的示意图来表示。下列说法不正确的是

选项 | 横坐标 | 纵坐标 | 研究对象 |
A | 反应过程 | 能量 | NH4Cl和Ba(OH)2 ·8H2O反应 |
B | 反应温度 | 反应速率 | 酶催化反应 |
C | HCl溶液体积 | 沉淀质量 | 0.1 mol·L-1盐酸滴加到同浓度AgNO3溶液中 |
D | 反应时间 | 溶液温度 | 足量未打磨的镁条放在1mol·L-1H2SO4溶液中 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有OH-、CO32-、A1O2-、SiO32-、SO42-、HCO3-、Na+、Fe3+、Mg2+、Al3+等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化如下图所示。下列说法正确的是
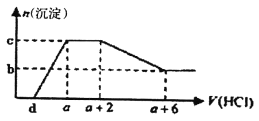
A. 原溶液中可能含有Na2SO4、可能不含有CO32-
B. 原溶液中一定含有的阴离子只有:OH-、A1O2-、CO32-
C. 原溶液中含CO32-与A1O2-的物质的量之比为3:4
D. a-d>3/4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com