
【题目】微量元素是指每种质量不到体重的万分之一,质量总和不到人体质量的千分之一的近二十种元素,这些元素对人体正常代谢和健康起着重要作用.下列元素不是微量元素的是( )
A.I
B.H
C.Zn
D.Fe
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】实验室用硫酸铝酸性溶液制备可溶性的碱式硫酸铝[Ala(SO4)b(OH)c],并用它对烟气进行脱硫处理的过程如图1: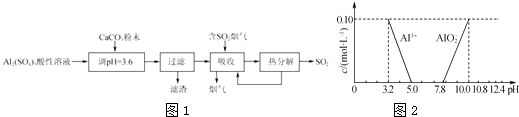
(1)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Ala(SO4)b(OH)c . 过滤时所用的玻璃仪器有、和烧杯,滤渣的主要成分为(填化学式).
(2)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将(填“增大”“减小”或“不变”).
(3)Ala(SO4)b(OH)c中a、b、c的代数关系式为 .
(4)已知在常温下溶液中Al3+、AlO2﹣的浓度与溶液pH的关系如图2所示.为确定碱式硫酸铝的组成,进行如下实验:
①取2.18g碱式硫酸铝样品在空气中灼烧至恒重,样品质量减少了0.36g.
②另取2.18g碱式硫酸铝溶于水,调节溶液的pH到5.0~7.8.
③将②产生的沉淀过滤、洗涤、灼烧至恒重,称量剩余固体为1.02g.
请计算样品中Al3+和SO42﹣的物质的量之比(写出计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各图均能表示甲烷的分子结构,按要求回答下列问题。


(1)甲烷的球棍模型是________,甲烷的电子式是__________ (填序号)。甲烷的空间构型是__________________。
(2)写出甲烷与氯气发生反应的化学方程式_____________(只写第一步),该反应的反应类型是________________。
(3)相对分子质量为72的烷烃的分子式是_______________。
(4)甲烷与丙烷互为______
A.同位素
B.同素异形体
C.同系物
D.同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期第ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)工业上用砷废渣制H3AsO4的反应为:2As2S3+5O2+6H2O=4H3AsO4+6S,通常将含砷废渣(主要成分为As2S3)制成浆状,加压通O2氧化。分别分析“制成浆状”、“ 加压通O2”对该反应的影响___________________。
(2)已知:As(s)+ ![]() H2(g)+2O2(g)=H3AsO4(s) △H1
H2(g)+2O2(g)=H3AsO4(s) △H1
2As(s)+O2(g)=As2O5(s) △H2
H2(g)+ ![]() O2(g)=H2O(l) △H3
O2(g)=H2O(l) △H3
则反应As2O5(s)+3H2O(l)=2H3AsO4(s) 的△H=______________。
(3)H3AsO3 和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的依度占各物种浓度之和的分数)与pH的关系分别如图1和图2所示。

①以酚酞为指示剂(变色范围pH:8.0~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为红色时停止滴加。该过程中主要反应的离子方程式为_______________。
②已知H3AsO4的各级电离常数为Ka1、Ka2、Ka3,则Ka2=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某微粒的结构示意图为 ,试回答:
,试回答:
(1)x表示____________,y表示____________。
(2)当x-y > 10时,该微粒是________(选填“阳离子”或“阴离子”或“原子”)
(3)当![]() 时,该微粒带有2个单位的负电荷,则该微粒的符号为_________,该微粒的结构示意图为____________
时,该微粒带有2个单位的负电荷,则该微粒的符号为_________,该微粒的结构示意图为____________
(4)当y=2的中性原子M跟y=7的中性原子N化合时,形成化合物的化学式为__
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂排出的铬渣含有SiO2、A12O3、Fe2O3、Na2Cr2O7(易溶于水,是强氧化剂)等,处理建议是将+6价铬转化为低毒性的+3价铬后制备K2Cr2O7。实验室模拟处理铬渣的工艺流程如下(部分操作和条件略):

(1)已知过滤1后的滤液中存在如下平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+,则滤液应呈现的颜色是_________
2CrO42-(黄色)+2H+,则滤液应呈现的颜色是_________
(2)滤渣1的成分为______ 滤渣2中所含的金属元素为___________
(3)根据表中生成成氧化物沉淀的pH数据判断,流程中a的范围为__________。
物质 | Fe(OH)3 | Al(OH)3 | Cr(OH)3 | Fe(OH)2 |
开始沉淀 | 1.5 | 3.4 | 4.9 | 6.3 |
完全沉淀 | 2.8 | 4.7 | 5.5 | 8.3 |
(4)过滤3所得滤液又回流到过滤1所得滤液中,其目的是__________
(5)由Cr(OH)3得到黄色溶液过程中发生的反应的离子方程式是_________
(6)向橙色的K2Cr2O7溶液中,滴加Ba(NO3)2溶液,产生黄色沉淀,溶液pH减小。试推测黄色沉淀是_________,用平衡移动的原理解释溶液pH变小的原因是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中Q单质可制成半导体材料.下列判断正确的是( )
A.W形成的离子半径大于T形成的离子半径
B.W的单质在过量氧气中燃烧生成WO3
C.最高价氧化物的水化物的酸性:R<Q
D.T是地壳中含量最多的金属元素,其单质的化学性质较活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10﹣5 |
下列说法不正确的是( )
A.上述生成Ni(CO)4(g)的反应为放热反应
B.25℃时反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数为2×10﹣5
C.80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2 mol/L
D.在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol/L,则此时v(正)>v(逆)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com