
【题目】K2FeO4在水中不稳定,发生反应:4FeO42-+10H2O![]() 4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如图所示。下列说法不正确的是
4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如图所示。下列说法不正确的是

A. 由图Ⅰ可知K2FeO4的稳定性随温度的升高而减弱
B. 由图Ⅱ可知图中a>c
C. 由图Ⅰ可知温度:T1>T2>T3
D. 由图Ⅰ可知上述反应△H>0
【答案】B
【解析】
A、由图1数据可知,温度越高,相同时间内FeO42-浓度变化越快,高铁酸钾溶液平衡时FeO42-浓度越小,温度越高FeO42-浓度越小,所以K2FeO4的稳定性随着温度的升高而减弱,故A正确;
B、pH越小,氢离子浓度越大,由4FeO42-+10H2O=4Fe(OH)3(胶体)+8OH-+3O2↑可知:氢离子浓度增大,平衡向正反应方向移动,高铁酸钾溶液平衡时FeO42-浓度越小,pH越小,由图知a<c,故B错误;
C、温度越高,反应速率越快,相同时间内FeO42-浓度变化越快,则由图Ⅰ可知温度:T1>T2>T3,故B正确;
D、温度越高FeO42-浓度越小,正向反应是吸热反应,说明平衡正向移动,即ΔH>0,故D正确;
综上所述,本题正确答案为B。


科目:高中化学 来源: 题型:
【题目】下图是2SO3(g)![]() 2SO2(g)+O2(g)的能量变化图,据图得出的相关叙述正确的是( )
2SO2(g)+O2(g)的能量变化图,据图得出的相关叙述正确的是( )
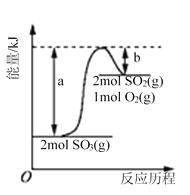
A. 该化学反应过程中既有能量的吸收又有能量的释放
B. 2SO3(g)![]() 2SO2(g)+O2(g) △H=-(a-b) kJ/mol
2SO2(g)+O2(g) △H=-(a-b) kJ/mol
C. 1 mol SO2的能量比1 mol SO3的能量高
D. 若某容器内有2 mol SO3充分反应,吸收(a-b) kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以有机物A为基础物质,可以通过不同的反应制得下列物质。
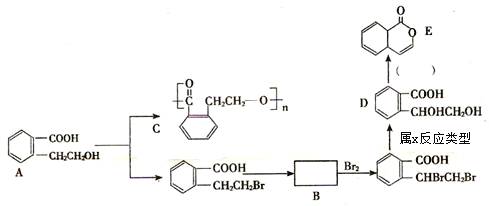
(1)写出A→C的化学方程式:__________________________________________。
(2)推断B物质的结构简式______________________;X反应类型是___________;由 D → E 所需的试剂是_______________________________。
(3)R物质属于A 的同分异构体,其性质如下:
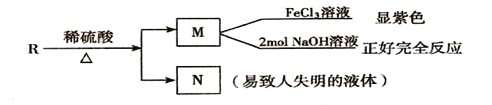
试写出符合条件的R的同分异构体的结构简式(任写两种):__________;________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属腐蚀与防护的说法不正确的是
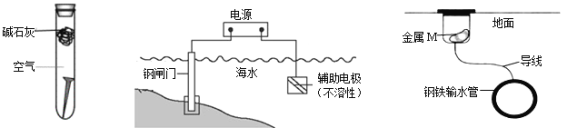
图① 图② 图③
A. 图①,放置于干燥空气中的铁钉不易生锈
B. 图②,若断开电源,钢闸门将发生吸氧腐蚀
C. 图②,若将钢闸门与电源的正极相连,可防止钢闸门腐蚀
D. 图③,若金属M比Fe活泼,可防止输水管腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A | B | C | D |
通电一段时间后,搅拌均匀,溶液的pH增大 | 此装置可实现 铜的精炼 | 盐桥中的K+ 移向FeCl3溶液 | 若观察到甲烧杯中石墨电极附近先变红,则乙烧杯中铜电极为阳极 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的,如下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化。则下列说法正确的是

A. 通常情况下,NO比N2稳定
B. 通常情况下,N2(g)和O2(g)混合能直接生成NO
C. 1molN2(g)和1molO2(g)具有的总能量小于2mol NO(g)具有的总能量
D. 1molN2(g)和1molO2(g)反应放出的能量为180kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。下图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是
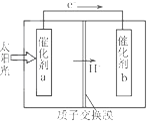
A. 该过程是将太阳能转化为化学能的过程
B. 催化剂a表面发生氧化反应,有O2产生
C. 催化剂a附近酸性减弱,催化剂b附近酸性增强
D. 催化剂b表面的反应是CO2+2H++2e一=HCOOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有K2Cr2O7的废水具有较强的毒性,工业上常用钡盐沉淀法处理含有K2Cr2O7的废水并回收重铬酸,具体的流程如下:
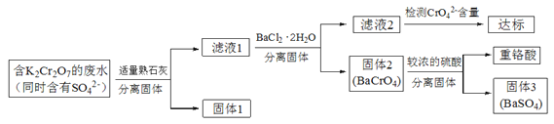
已知:i. CaCr2O7、BaCr2O7易溶于水,其它几种盐在常温下的溶度积如下表所示。
物质 | CaSO4 | CaCrO4 | BaCrO4 | BaSO4 |
溶度积 |
|
|
|
|
ii. Cr2O72-+ H2O![]() 2 CrO42-+ 2H+
2 CrO42-+ 2H+
(1)向滤液1中加入BaCl2·H2O的目的,是使CrO42-从溶液中沉淀出来。
①结合上述流程说明熟石灰的作用是_______________________________。
②结合表中数据,说明选用Ba2+而不选用Ca2+处理废水的理由是________________。
③研究温度对CrO42-沉淀效率的影响。实验结果如下:在相同的时间间隔内,不同温度下CrO42-的沉淀率![]() ,
,
如下图所示。
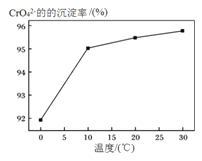
已知:BaCrO4(s) ![]() Ba2+ (aq) + CrO42-(aq)
Ba2+ (aq) + CrO42-(aq)
CrO42-的沉淀效率随温度变化的原因是___________________________________。
(2)向固体2中加入硫酸,回收重铬酸。
① 硫酸浓度对重铬酸的回收率如下图(左)所示。结合化学平衡移动原理,解释使用0.450 mol/L的硫酸时,重铬酸的回收率明显高于使用0.225 mol/L的硫酸的原因是_________________________________。
② 回收重铬酸的原理如下图(右)所示。当硫酸浓度高于0.450 mol/L时,重铬酸的回收率没有明显变化,其原因是_______________________________。
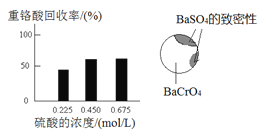
(3)综上所述,沉淀BaCrO4并进一步回收重铬酸的效果与___________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着资源的开发和现代化工业的发展,你认为减少酸雨以保护环境可采取的措施是( )
①尽量少用煤作燃料 ②把工厂的烟囱加高 ③将燃料脱硫后再燃烧
④开发新的清洁能源 ⑤植树造林 ⑥在已酸化的土壤中加石灰
A.①②③④B.③④⑤⑥C.①③④D.①③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com