
【题目】实验室以一种工业废渣(含80%~90%的Ca(OH)2,其余为焦炭等不溶物)为原料制备KClO3的实验过程如下:

几种物质的溶解度如下图:

⑴反应I的目的是制备Ca(ClO3)2,写出该反应的化学方程式:_____________;在通入Cl2和O2比例、废渣量均一定的条件下,为使Cl2转化完全,可采取的合理措施是____________。
⑵若过滤时滤液出现浑浊,其可能的原因是_____________(填序号)。
A.漏斗中液面高于滤纸边缘 B.滤纸已破损 C.滤纸未紧贴漏斗内壁
⑶所加试剂Y选用KCl而不用KNO3的原因是_____________。
⑷已知:4KClO3![]() 3KClO4 +KCl;2KClO3
3KClO4 +KCl;2KClO3![]() 2KCl+3O2↑。实验室可用KClO3制备高纯KClO4固体,实验中必须使用的用品有:热过滤装置(如下图所示)、冰水。
2KCl+3O2↑。实验室可用KClO3制备高纯KClO4固体,实验中必须使用的用品有:热过滤装置(如下图所示)、冰水。

①热过滤装置中玻璃漏斗的下端露出热水浴部分不宜过长,其原因是_____________。
②请补充完整由KClO3制备高纯KClO4固体的实验方案:
向坩埚中加入一定量的KClO3,_____________,在低温下干燥得KClO4固体。
【答案】⑴2Ca(OH)2+2Cl2+5O2= 2Ca(ClO3)2+2H2O
缓慢通入Cl2、O2(搅拌浆料或控制合适的温度) ⑵AB
⑶防止产物KClO3中含有较多的KNO3杂质
⑷①防止滤液冷却析出的晶体堵塞漏斗 ②控制温度400℃,使KClO3充分分解,将所得固体溶于水并煮沸至有大量固体析出,用热过滤装置过滤,并用冰水洗涤滤渣2~3次
【解析】⑴根据流程图,反应I中氯气、氧气和氢氧化钙反应生成了Ca(ClO3)2,反应的化学方程式为2Ca(OH)2+2Cl2+5O2= 2Ca(ClO3)2+2H2O;在通入Cl2和O2比例、废渣量均一定的条件下,充分搅拌浆料或控制合适的温度,可以使Cl2转化完全,故答案为:2Ca(OH)2+2Cl2+5O2= 2Ca(ClO3)2+2H2O;搅拌浆料或控制合适的温度;
⑵当漏斗中液面高于滤纸边缘,滤纸破损均会使滤液出现浑浊,故选AB;
⑶如果所加试剂Y选用KNO3,根据溶解度曲线,产物KClO3中可能含有较多的KNO3杂质,故答案为:防止产物KClO3中含有较多的KNO3杂质;
⑷①如果热过滤装置中玻璃漏斗的下端露出热水浴部分过长,过滤时滤液冷却析出的晶体堵塞漏斗,故答案为:防止滤液冷却析出的晶体堵塞漏斗;
②根据溶解度曲线可知, KClO4的溶解度较小,结合4KClO3![]() 3KClO4 +KCl;2KClO3
3KClO4 +KCl;2KClO3![]() 2KCl+3O2↑,可知,由KClO3制备高纯KClO4固体时:向坩埚中加入一定量的KClO3,控制温度400℃,使KClO3充分分解,将所得固体溶于水并煮沸至有大量固体析出,用热过滤装置过滤,并用冰水洗涤滤渣2~3次,在低温下干燥得KClO4固体,故答案为:控制温度400℃,使KClO3充分分解,将所得固体溶于水并煮沸至有大量固体析出,用热过滤装置过滤,并用冰水洗涤滤渣2~3次。
2KCl+3O2↑,可知,由KClO3制备高纯KClO4固体时:向坩埚中加入一定量的KClO3,控制温度400℃,使KClO3充分分解,将所得固体溶于水并煮沸至有大量固体析出,用热过滤装置过滤,并用冰水洗涤滤渣2~3次,在低温下干燥得KClO4固体,故答案为:控制温度400℃,使KClO3充分分解,将所得固体溶于水并煮沸至有大量固体析出,用热过滤装置过滤,并用冰水洗涤滤渣2~3次。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】亚氯酸钠( NaCl02)是一种高效氧化剂和漂白剂,主要用于棉纺、纸张漂白、食品消毒、水处理等。已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2![]() 3H2O,高于38 ℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。纯ClO2易分解爆炸。一种制备亚氯酸钠粗产品的工艺流程如下:
3H2O,高于38 ℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。纯ClO2易分解爆炸。一种制备亚氯酸钠粗产品的工艺流程如下:

(1) ClO2发生器中的离子方程式为 ,发生器中鼓人空气的作用可能是__________(选填序号)。
a.将SO2氧化成SO3,增强酸性
b.稀释ClO2以防止爆炸
c.将NaClO3还原为ClO2
(2)吸收塔内反应的化学方程式为 ,吸收塔的温度不能超过20℃,其原因是_____________。
(3)从“母液”中可回收的主要物质是 。
(4)从吸收塔中可获得NaCl02溶液,从NaCl02溶液到粗产品(NaClO2)经过的操作步骤依次为:①减压,55℃蒸发结晶;② ;③ ;④低于60℃干燥,得到成品。
(5)为测定粗品中NaCl02的质量分数,做如下实验:
准确称取所得亚氯酸钠样品10.00 g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴人适量的稀硫酸,充分反应(ClO2-+ 4I-+ 4H+= 2H2O+ 2I2+ Cl-)。将所得混合液配成250mL待测溶液,取25.00 mL待测液,用2.000 mol.L-lNa2S203标准液滴定(I2+2S2O32-= 2I-+S4O62-),测得消耗Na2SO3溶液平均值为16.40mL。该样品中NaClO2的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只用一种试剂就可将AgNO3、KSCN、稀H2SO4、NaOH四种无色溶液区分开,该试剂是
A.BaCl2溶液 B.FeCl2溶液 C.FeCl3溶液 D.Fe(NO3)3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表前三周期的一部分。
X | Z | ||
W | Y | R | |
(1)X的氢化物的沸点与W的氢化物比较,沸点较高的是:______________(填化学式),原因是_____________________。
(2)从下列选项中选出X的基态原子的最外层原子轨道表示式____________,另一原子轨道表示式不能作为基态原子的轨道表示式是因为它不符合____________。(填序号)。
A. 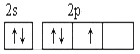 B.
B. 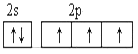
C.泡利原理 D.洪特规则
(3)以上W、Y、R元素原子失去核外第一个电子需要能量由多到少的顺序为:_______________(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题(用化学用语表示):
![]()
(1)在这些元素中,化学性质最不活泼的是____________,其原子结构示意图为____________。元素K是____________,在周期表中的位置是__________________。
(2)最高价氧化物对应水化物中碱性最强的化合物是______________。
(3)某元素二价阳离子的核外有10个电子,该元素是__________。
(4)G、H、I形成的简单气态氢化物稳定性由强到弱的顺序是______________________________。
(5)F、H、J的最高价氧化物对应水化物的酸性由强到弱的顺序是______________________。
(6)I、J、K三种元素形成的离子,离子半径由大到小的顺序是________________________。
(7)元素I的氢化物的结构式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是

A. 原子半径:Z>Y>X
B. 气态氢化物的稳定性:R>W
C. WX3和水反应形成的化合物是离子化合物
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝和铝合金是生活中常用的材料,下列说法正确的是
A.铝合金的熔点比纯铝高 B.铝合金的硬度比纯铝小
C.铝合金腐蚀时,铝不反应 D.可用铝制容器用来烧水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置应用于实验室进行相关实验,能达到实验目的的是

A. 用装置甲在光照条件下验证甲烷与氯气的反应
B. 用装置乙除去甲烷中少量的乙烯得纯净甲烷
C. 用装置丙分离乙醇和乙酸的混合液
D. 用装置丁分馏石油并收集60~150℃馏分
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com