
【题目】下表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题(用化学用语表示):
![]()
(1)在这些元素中,化学性质最不活泼的是____________,其原子结构示意图为____________。元素K是____________,在周期表中的位置是__________________。
(2)最高价氧化物对应水化物中碱性最强的化合物是______________。
(3)某元素二价阳离子的核外有10个电子,该元素是__________。
(4)G、H、I形成的简单气态氢化物稳定性由强到弱的顺序是______________________________。
(5)F、H、J的最高价氧化物对应水化物的酸性由强到弱的顺序是______________________。
(6)I、J、K三种元素形成的离子,离子半径由大到小的顺序是________________________。
(7)元素I的氢化物的结构式为________________。
【答案】 Ar(或氩) 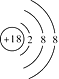 Cl(或氯) 第三周期第ⅦA族 NaOH(或氢氧化钠) Mg(或镁) H2O>NH3>PH3 H2SO4>H3PO4>H2SiO3 S2->Cl->O2- H—O—H、H—O—O—H
Cl(或氯) 第三周期第ⅦA族 NaOH(或氢氧化钠) Mg(或镁) H2O>NH3>PH3 H2SO4>H3PO4>H2SiO3 S2->Cl->O2- H—O—H、H—O—O—H
【解析】根据元素在周期表中的相对位置可知A~L分别是H、Na、Mg、Al、C、Si、N、P、O、S、Cl、Ar,则
(1)在这些元素中,化学性质最不活泼的是稀有气体元素Ar,其原子结构示意图为 。元素K是Cl,在周期表中的位置是第三周期第ⅦA族。(2)最高价氧化物对应水化物中碱性最强的化合物是NaOH。(3)某元素二价阳离子的核外有10个电子,该元素的质子数是10+2=12,是Mg。(4)非金属性越强,氢化物越稳定,因此G、H、I形成的简单气态氢化物稳定性由强到弱的顺序是H2O>NH3>PH3。(5)非金属性越强,最高价氧化物水化物的酸性越强,则F、H、J的最高价氧化物对应水化物的酸性由强到弱的顺序是H2SO4>H3PO4>H2SiO3。(6)离子的核外电子层数越多,离子半径越大,核外电子排布相同时,离子半径随原子序数的增大而减小,因此I、J、K三种元素形成的离子的离子半径由大到小的顺序是S2->Cl->O2-。(7)元素I的氢化物是水或双氧水,结构式为H-O-H或H-O-O-H。
。元素K是Cl,在周期表中的位置是第三周期第ⅦA族。(2)最高价氧化物对应水化物中碱性最强的化合物是NaOH。(3)某元素二价阳离子的核外有10个电子,该元素的质子数是10+2=12,是Mg。(4)非金属性越强,氢化物越稳定,因此G、H、I形成的简单气态氢化物稳定性由强到弱的顺序是H2O>NH3>PH3。(5)非金属性越强,最高价氧化物水化物的酸性越强,则F、H、J的最高价氧化物对应水化物的酸性由强到弱的顺序是H2SO4>H3PO4>H2SiO3。(6)离子的核外电子层数越多,离子半径越大,核外电子排布相同时,离子半径随原子序数的增大而减小,因此I、J、K三种元素形成的离子的离子半径由大到小的顺序是S2->Cl->O2-。(7)元素I的氢化物是水或双氧水,结构式为H-O-H或H-O-O-H。


 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】将足量NO2通入下列各溶液中,所含离子还能大量共存的是( )
A.Fe2+、CH3COO﹣、SO42﹣、Na+
B.Ca2+、K+、Cl﹣、HCO3﹣
C.NH4+、Al3+、NO3﹣、Cl﹣
D.K+、Na+、SO32﹣、AlO2﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各溶液中水的电离程度最大的是( )
A. pH=1的硫酸溶液B. c(H+ )=10-10 mol/L纯碱溶液
C. 0.01mol/L的烧碱溶液D. c(H+ )=10-5 mol/L的硫酸铵溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.重铬酸钾(K2Cr2O7)是一种强氧化剂,在实验室和工业中都有很广泛的应用。同时,由于其具有致癌作用,也是环境污染物之一,必须进行处理。工业上通常以铬铁矿(主要成分为FeO·Cr2O3,另外还含有SiO2、Al2O3等杂质)为原料制备重铬酸钾,主要流程如下图所示:

已知:①NaFeO2遇水强烈水解,生成红褐色物质;
②2CrO42- (黄色)+2H+![]() Cr2O72- (橙色)+H2O。
Cr2O72- (橙色)+H2O。
请回答下列问题:
(1)滤液1的溶质除Na2CrO4、Na2SiO3外,还含有________________(填化学式);
(2)由滤液2转化为Na2Cr2O7溶液过程中,能说明反应达平衡状态的是________(填字母代号);
a.溶液的颜色不变
b.v(CrO![]() )=2v(Cr2O
)=2v(Cr2O![]() )
)
c.Cr2O![]() 和CrO
和CrO![]() 的浓度相同
的浓度相同
(3)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是加热浓缩、______________、过滤、洗涤、干燥。
Ⅱ.工业废水中常含有一定量的Cr2O![]() 和CrO
和CrO![]() ,常用还原沉淀法处理。该方法的工艺流程为:
,常用还原沉淀法处理。该方法的工艺流程为:
CrO![]()
![]() Cr2O
Cr2O![]()
![]() Cr3+
Cr3+![]() Cr(OH)3
Cr(OH)3
(4)请写出Cr2O![]() 与FeSO4溶液在酸性条件下反应的离子方程式:______________________。
与FeSO4溶液在酸性条件下反应的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求完成下列问题:
(1)某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,试回答:
该元素价电子排布式_____________________。
(2)外围电子排布式为3d54s2的原子,其原子结构示意图为____________,其最高正价为________;其在元素周期表中的位置为:___________________。
(3)下列分子中是否有手性原子:_________(填“有”或“无”,若有请在图中碳原子下方用“*”标出)

(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧、PCl3中,属于非极性分子的是(填番号)________________。
(5) 试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):
HClO3________HClO4; H3PO4________H3PO3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以一种工业废渣(含80%~90%的Ca(OH)2,其余为焦炭等不溶物)为原料制备KClO3的实验过程如下:

几种物质的溶解度如下图:

⑴反应I的目的是制备Ca(ClO3)2,写出该反应的化学方程式:_____________;在通入Cl2和O2比例、废渣量均一定的条件下,为使Cl2转化完全,可采取的合理措施是____________。
⑵若过滤时滤液出现浑浊,其可能的原因是_____________(填序号)。
A.漏斗中液面高于滤纸边缘 B.滤纸已破损 C.滤纸未紧贴漏斗内壁
⑶所加试剂Y选用KCl而不用KNO3的原因是_____________。
⑷已知:4KClO3![]() 3KClO4 +KCl;2KClO3
3KClO4 +KCl;2KClO3![]() 2KCl+3O2↑。实验室可用KClO3制备高纯KClO4固体,实验中必须使用的用品有:热过滤装置(如下图所示)、冰水。
2KCl+3O2↑。实验室可用KClO3制备高纯KClO4固体,实验中必须使用的用品有:热过滤装置(如下图所示)、冰水。

①热过滤装置中玻璃漏斗的下端露出热水浴部分不宜过长,其原因是_____________。
②请补充完整由KClO3制备高纯KClO4固体的实验方案:
向坩埚中加入一定量的KClO3,_____________,在低温下干燥得KClO4固体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食醋的主要成分是乙酸,下列物质在一定条件下能与乙酸发生反应的是( )
①石蕊;②乙醇;③金属铜;④金属铝;⑤氧化镁;⑥碳酸钙;⑦氢氧化铜
A. ①③④⑤⑥B. ②④⑦C. ①②④⑤⑥⑦D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用氯化铵与氢氧化钙的固体混合加热制取氨气,实验室提供的有关装置见下表:
气体发生装置 |
a |
b |
c |
气体收集装置 |
|
|
|
完成下列填空:
(1)从上图中选择实验室制取氨气的发生装置_____(选填编号)、收集装置____(选填编号)。
(2)用注射器收集50 mL纯净的氨气,然后再抽取10 mL滴有酚酞试液的蒸馏水,并用橡皮塞封闭针头。充分振荡后注射器内_______(选填“有”“无”)气体剩余,液体呈___色,用化学方程式解释液体颜色变化的原因_____________________。
(3)工业合成氨的简易流程如下:

通过循环Ⅰ可利用的气态物质是_______
a.催化剂 b.只有N2 c.只有H2 d.N2和H2
(4)将 CO2通入到氨化的饱和食盐水中制备NaHCO3固体,反应的化学方程式__________。
(5)NH3、PH3、AsH3三种氢化物热稳定性由强到弱的顺序是_______,理由是___________。
(6)工业上用氨水吸收SO2尾气,最终得到化肥 (NH4)2SO4。(NH4)2SO4溶液呈_______性,用离子方程式解释原因__________________;该溶液中存在多种守恒,用离子浓度表示其中一种守恒关系________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定体积的CH4在密闭容器中与一定量的氧气燃烧后得到的产物为CO、CO2和水蒸气,此混合气重4.96g,当其缓慢经过浓硫酸时,浓硫酸增重2.52g。原混合气体中CO2的质量为( )
A. 1.25g B. 1.97g C. 2.44g D. 1.32g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com