
【题目】在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表,v的单位为[mol/(L·min)]。下列判断错误的是( )
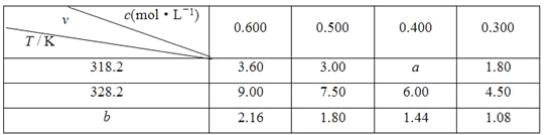
A.318.2 K,蔗糖起始浓度为0.400 mol/L,10 min后蔗糖浓度略大于0.376 mol/L
B.bK时,若蔗糖的浓度为0.35 mol/L,则v=1.26 mmol/(L·min)
C.b<318.2
D.若同时改变反应温度和蔗糖的浓度,则v肯定变化
【答案】D
【解析】
A. 由表可知温度由318.2→328.2℃,在浓度相同的情况下![]() =0.4,确定a,随着反应的进行,速率逐渐减小;
=0.4,确定a,随着反应的进行,速率逐渐减小;
B. 由标准数据可知相同温度下,反应速率与浓度呈正比;
C. 相同浓度时,温度越高,则反应速率越大;
D. 由表可知温度由318.2℃→b,浓度由0.3mol/L→0.5mol/L,速率相等。
A. 由表可知温度由318.2→328.2℃,在浓度相同的情况下![]() =0.4;则a=0.4×6=2.4,如保持速率不变,则10 min后蔗糖浓度等于0.376 mol/L,随着反应的进行,速率逐渐减小,则10min后蔗糖浓度略大于0.376 mol/L,A正确;
=0.4;则a=0.4×6=2.4,如保持速率不变,则10 min后蔗糖浓度等于0.376 mol/L,随着反应的进行,速率逐渐减小,则10min后蔗糖浓度略大于0.376 mol/L,A正确;
B. 由标准数据可知相同温度下,反应速率与浓度呈正比,b K时,速率与浓度比值为![]() =3.6,则b K时,若蔗糖的浓度为0.35 mol/L,则v=0.35 mol/(Lmin)×3.6=1.26 mol/(Lmin),B正确;
=3.6,则b K时,若蔗糖的浓度为0.35 mol/L,则v=0.35 mol/(Lmin)×3.6=1.26 mol/(Lmin),B正确;
C. 相同浓度时,温度越高,则反应速率越大,对比318.2和b的数据可知,b<318.2,故C正确;
D. 由表可知温度由318.2℃→b,浓度由0.3mol/L→0.5mol/L,速率相等,都是1.80,所以v可能不变,D错误;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如下微型实验装置。实验时,现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是

A. 断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl—![]() Cl2↑+H2↑
Cl2↑+H2↑
B. 断开K2,闭合K1时,石墨电极附近溶液变红
C. 断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e—=2Cl—
D. 断开K1,闭合K2时,石墨电极作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达平衡,平衡常数K=c(CO)c(H2O)/c(CO2)c(H2),恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A.该反应的ΔH>0
B.恒温恒容条件下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为CO+H2O![]() CO2+H2
CO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知:![]()
烃基烯基醚A的相对分子质量(Mr)为176,分子中碳氢原子数目比为3:4,与A相关的反应如下:

请回答下列问题:
(1)A的分子式为__,B的名称是__;
(2)写出C→D反应的化学方程式:__;
(3)链烃M的相对分子质量比B多24,分子中所有碳原子均在同一平面上,其结构简式是__;
Ⅱ.由E转化为对甲基苯乙炔(![]() )的一条路线如下:
)的一条路线如下:

(4)①反应中所加试剂是__; ③的反应类型是__;
(5)写出G的结构简式:__;
(6)写出两种同时符合下列条件的E的同分异构体的结构简式:__。
①属于芳香醛;
②苯环上有两种不同环境的氢原子.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。
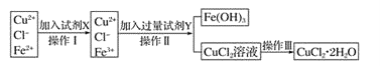
请参照下表给出的数据填空。

(1)操作I加入X的目的是___________________________ 。
(2)下列物质都可以作为X,适合本实验的X物质可以是_________(填字母)。
A KMnO4 B NaClO C H2O2 D Cl2
(3)操作II的Y试剂为____________(填化学式),并调节溶液的pH在______范围。
(4)实验室在配制CuCl2溶液时需加入少许_________(填物质名称),理由是(文字叙述并用有关离子方程式表示)__________________________________________。
(5)若将CuCl2溶液蒸干灼烧,得到的固体是_________________(填化学式);若要得无水CuCl2,请简述操作方法______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、M的原子序数依次增大,它们组成一种团簇分子,结构如图所示。X、M的族序数均等于周期序数,Y原子核外最外层电子数是其电子总数的![]() 。下列说法正确的是( )
。下列说法正确的是( )
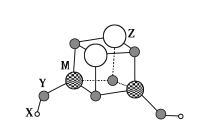
A.简单离子半径:Z>M>Y
B.常温下Z和M的单质均能溶于浓硝酸
C.X+与Y22-结合形成的化合物是离子晶体
D.Z的最高价氧化物的水化物是中强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学习小组进行如下实验。
【探究反应速率的影响因素】设计了如下的方案并记录实验结果(忽略溶液混合体积变 化)。限选试剂和仪器:0.20mol/LH2C2O4 溶液、0.010mol/L KMnO4 溶液(酸性)、蒸馏水、 试管、量筒、秒表、恒温水浴槽
(1)上述实验①②是探究 对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则 a 为 ;乙是实验需要测量的物理量,则表 格中“乙”应填写 。
【测定 H2C2O4·xH2O 中 x 值】 已知:M(H2C2O4)=90g/mol
称取 1.260 g 纯草酸晶体,将其酸制成 100.00 mL 水溶液为待测液。
②取 25.00 mL 待测液放入锥形瓶中,再加入适的稀 H2SO4
③用浓度为 0.05000 mol·L-1 的 KMnO 标准溶液进行滴定;
(2)请写出与滴定有关反应的离子方程式
(3)某学生的滴定方式(夹持部分略去)如下,最合理的是 (选填 a、b)。


(4)由右图可知消耗 KMnO4 溶液体积为 mL;
(5)滴定过程中眼睛应注视_________________;
(6)通过上述数据,求得 x= 。以标准 KMnO4 溶液滴定样品溶液的浓度,未用 标准 KMnO4 溶液润洗滴定管,引起实验结果 (偏大、偏小或没有影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在2L密闭容器中加入一定量的MoS2、H2、Na2CO3发生反应:MoS2(s)+4H2(g) +2Na2CO3(s) ![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s)。能说明该反应达到平衡状态的是
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s)。能说明该反应达到平衡状态的是
A.![]()
B.容器内气体的密度不变
C.平衡常数K不变
D.CO与H2O的物质的量浓度的比值不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,![]() 和
和![]() 的电离常数分别为
的电离常数分别为![]() 和
和![]() 。将
。将![]() 和体积均相同的两种酸溶液分别稀释,其
和体积均相同的两种酸溶液分别稀释,其![]() 随加水体积的变化如图所示。下列叙述正确的是( )
随加水体积的变化如图所示。下列叙述正确的是( )

A. 曲线Ⅰ代表![]() 溶液
溶液
B. 溶液中水的电离程度:b点>c点
C. 从c点到d点,溶液中 保持不变(其中
保持不变(其中![]() 、
、![]() 分别代表相应的酸和酸根离子)
分别代表相应的酸和酸根离子)
D. 相同体积a点的两溶液分别与![]() 恰好中和后,溶液中
恰好中和后,溶液中![]() 相同
相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com