
【题目】为探讨化学平衡移动原理与氧化还原反应规律的联系,实验如下。

下列说法不正确的是
A. 试管i溶液变蓝证明有I2生成
B. 结合试管i、ii中现象,可知2Fe3++2I-![]() 2Fe2++I2
2Fe2++I2
C. 试管iii中溶液褪色说明I2转化为I-,此时I-还原性强于Fe2+
D. 对比实验I和试管iii中现象,说明物质的氧化性与还原性强弱受浓度影响
【答案】C
【解析】
实验中Fe3+与I-发生氧化还原反应,实验II中淀粉遇碘单质变蓝,可知生成碘,黄色溶液与KSCN混合溶液变红可知溶液中还存在Fe3+,与硝酸银反应生成黄色沉淀,可知反应后溶液中含I-,结合反应物的量可知,I-不足,则该氧化还原反应为可逆反应,以此来解答。
A.淀粉遇碘单质变蓝,则试管i溶液变蓝证明有I2生成,A正确;
B.由上述分析可知,发生反应为2Fe3++2I-![]() 2Fe2++I2,B正确;
2Fe2++I2,B正确;
C.试管iii中溶液褪色说明I2转化为I-,与平衡逆向移动有关,碘的浓度减小,C错误;
D.实验I和试管iii中现象,说明物质的氧化性与还原性强弱受浓度影响,D正确;
故合理选项是C。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质中,均属于共价化合物并且化学键类型完全相同的是( )
A. O2和CCl4B. NaH和HIC. Cl2和NH4NO3D. CCl4和H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修5:有机化学基础)
芳香烃A可以合成扁桃酸,也可以合成H。以下是合成线路(部分产物、反应条件已略去):

已知:
I、
II、![]()
III、
IV、D的相对分子质量为137,且在苯环的对位上有两个取代基
V、E为一溴取代物
请回答下列问题:
(1)扁桃酸中含氧官能团的名称是 ________;物质B的结构简式 ________。
(2)上述①~⑥反应中属于取代反应的是 ________(填序号)。
(3)关于H物质,下列说法正确的是 ________ (填字母序号)。
A.所有碳原子可能处于同一平面
B.可以发生加成反应、聚合反应、氧化反应和还原反应
C.H与G都能与新制Cu(OH)2反应
(4)写出反应⑥的化学方程式 ________。
(5)X是扁桃酸的同分异构体,1 mol X可与2 mol Na2CO3反应,其核磁共振氢谱有四组峰,峰面积之比为3:2:2:1,其结构简式为 ________ (任写两种)。
(6)请结合所学知识和上述信息,写出由A和乙醛为原料(无机试剂任用)制备肉桂醛(![]() )的合成路线流程图 ________。
)的合成路线流程图 ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)恒温下,向一个2L的恒容密闭容器中充入1 molN2和2.6 molH2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示。
时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
c(NH3)/(mol·L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①前20min的平均速率ν(H2)为__________,该温度下此反应化学平衡平衡常数为_________。
②能提高反应中N2的平衡转化率的是___________。
A.增加N2的浓度 B.增加H2的量 C.移出部分NH3
D.提高反应温度 E.加入合适的催化剂
(2)工业合成氨的反应为:N2(g)+3H2(g)![]() 2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的恒容密闭容器中达到平衡后。改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是___________________。
2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的恒容密闭容器中达到平衡后。改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是___________________。
A、充入氦气增大压强 B、增大反应物的浓度 C、使用催化剂 D、降低温度
(3)已知某化学反应的平衡常数表达式为K=[CO2]·[H2]/[CO]·[H2O],在不同的温度下该反应的平衡常数如下表:
t℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
该反应的化学方程是_________________________________;若在1 L的密闭容器中通入CO2和H2各1 mol,5 min后温度升高到830℃,此时测得CO2为0.4 mol,该反应__________达到平衡状态(填是或否)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 含有离子键的化合物必是离子化合物
B. 含有共价键的化合物就是共价化合物
C. 共价化合物可能含离子键
D. 离子化合物中不可能含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组欲探究SO2与Cu(OH)2 的反应。
实验 | 实验步骤 | 现象 |
| 步骤1:打开分液漏斗,向烧瓶中加入30mL 0.5 mol/LNaOH溶液 | I. 有蓝色絮状沉淀,静置后分层。 |
步骤2:从左侧导管通入SO2气体 | II. 静置后分层,上层溶液为淡绿色,底部有白色沉淀 |
(1)现象I中产生蓝色沉淀的离子方程式是___________。
(2)甲为了确认现象II中白色沉淀的成分,进行如下探究。查阅资料:
CuSO3 | CuCl | Cu2O | |
溶解性 | 不溶于水,浅黄色沉淀 | 不溶于水,白色沉淀 | 不溶于水,砖红色沉淀 |
性质 | 与酸反应 | 能溶于较浓的HCl溶液 | 酸性体系中不稳定,进一步反应生成Cu和Cu2+ |
并进行如下实验:
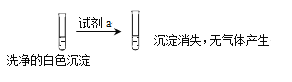
①试剂a是___________。
②现象II中生成白色沉淀的离子方程式是___________。
(3)甲认为Cu(OH)2沉淀全部转化为CuCl,乙依据实验现象对甲的观点进行反驳,依据的实验现象是_________。
(4)丙认为实验存在干扰,欲探究纯净的Cu(OH)2 悬浊液与SO2的反应。
①丙过滤I中的蓝色沉淀,洗涤,取最后一次洗涤液于试管中,_________(填操作和现象),证明已洗涤干净。再进行如下实验:
实验 | 实验步骤 | 现象 |
| 从左侧导管通入SO2气体 | III. 静置后分层,上层溶液为淡绿色,底部有砖红色沉淀。 |
②丙预测产物是Cu2O,取砖红色沉淀,洗涤后,_________(填操作和现象),证明产物是Cu2O。
(5)纯净的Cu(OH)2 悬浊液与SO2发生反应的化学方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)在漂白、电镀等方面应用广泛。以木炭浓硝酸、水和铜为原料制备亚硝酸钠的装置如图所示:

已知:
室温下,①2NO+Na2O2===2NaNO2
②3NaNO2+3HCl===3NaCl+HNO3+2NO↑+H2O
③酸性条件下,NO或NO2ˉ都能与MnO4ˉ反应生成NO3ˉ和Mn2+
回答下列问题:
(1)检查完该装置的气密性,装入药品后,实验开始前通入一段时间N2,然后关闭弹簧夹,再滴加浓硝酸,加热。通入N2的作用是________________________________________。
(2)装置B中观察到的主要现象为________________________________________,发生反应离子方程式是_____________。
(3)装置D的作用是______________________________,发生反应的离子方程式是________________________________________。
(4)预测C中反应开始阶段,固体产物除NaNO2外,还含有的副产物有Na2CO3和__________(写化学式)。为避免产生这些副产物,应在装置B、C间增加干燥管,则干燥管中盛放的试剂为__________(写名称)。
(5)利用改进后的装置将3.12gNa2O2完全转化为NaNO2,理论上至少需要木炭__________g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。下列说法正确的是( )
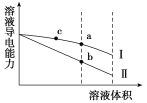
A. 两溶液稀释前的浓度相同
B. a、b、c三点溶液的pH由大到小顺序为a>b>c
C. a点的Kw值比b点的Kw值大
D. a点水电离的n(H+)大于c点水电离的n(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com