
【题目】某兴趣小组欲探究SO2与Cu(OH)2 的反应。
实验 | 实验步骤 | 现象 |
| 步骤1:打开分液漏斗,向烧瓶中加入30mL 0.5 mol/LNaOH溶液 | I. 有蓝色絮状沉淀,静置后分层。 |
步骤2:从左侧导管通入SO2气体 | II. 静置后分层,上层溶液为淡绿色,底部有白色沉淀 |
(1)现象I中产生蓝色沉淀的离子方程式是___________。
(2)甲为了确认现象II中白色沉淀的成分,进行如下探究。查阅资料:
CuSO3 | CuCl | Cu2O | |
溶解性 | 不溶于水,浅黄色沉淀 | 不溶于水,白色沉淀 | 不溶于水,砖红色沉淀 |
性质 | 与酸反应 | 能溶于较浓的HCl溶液 | 酸性体系中不稳定,进一步反应生成Cu和Cu2+ |
并进行如下实验:
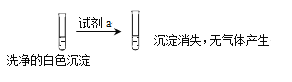
①试剂a是___________。
②现象II中生成白色沉淀的离子方程式是___________。
(3)甲认为Cu(OH)2沉淀全部转化为CuCl,乙依据实验现象对甲的观点进行反驳,依据的实验现象是_________。
(4)丙认为实验存在干扰,欲探究纯净的Cu(OH)2 悬浊液与SO2的反应。
①丙过滤I中的蓝色沉淀,洗涤,取最后一次洗涤液于试管中,_________(填操作和现象),证明已洗涤干净。再进行如下实验:
实验 | 实验步骤 | 现象 |
| 从左侧导管通入SO2气体 | III. 静置后分层,上层溶液为淡绿色,底部有砖红色沉淀。 |
②丙预测产物是Cu2O,取砖红色沉淀,洗涤后,_________(填操作和现象),证明产物是Cu2O。
(5)纯净的Cu(OH)2 悬浊液与SO2发生反应的化学方程式是_________。
【答案】Cu2++2OH-=Cu(OH)2↓ 浓HCl SO2+2Cu(OH)2+2Cl-=2CuCl+SO42-+2H2O 反应后上层为淡绿色溶液 滴加HNO3酸化的AgNO3溶液,无白色沉淀产生 加入适量H2SO4溶液,产生紫红色固体,溶液变蓝 3Cu(OH)2+SO2=Cu2O+CuSO4+3H2O
【解析】
(1)现象I中产生蓝色沉淀为氢氧化铜;
(2)由信息及实验操作可知,CuCl可溶于浓盐酸,无气体生成,可知二氧化硫与氯化铜发生氧化还原反应生成CuCl;
(3)上层溶液为淡绿色,可知铜离子剩余;
(4)①取最后一次洗涤液,检验氯离子不存在可说明洗涤干净;
②Cu2O在酸性体系中不稳定,进一步反应生成Cu和Cu2+;
(5)Cu(OH)2悬浊液与SO2发生反应生成Cu2O、CuSO4、水。
(1)现象I是NaOH与CuCl2发生复分解反应产生氢氧化铜沉淀也氯化钠,产生蓝色沉淀的离子方程式是Cu2++2OH-=Cu(OH)2↓;
(2)由信息及实验操作可知,CuCl可溶于浓盐酸,无气体生成,可知二氧化硫与氯化铜发生氧化还原反应生成CuCl,则试剂a是浓HCl,现象II中生成白色沉淀的离子方程式是SO2+2 Cu(OH)2+2Cl-=2CuCl+SO42-+2H2O;
(3)甲认为Cu(OH)2沉淀全部转化为CuCl,乙依据实验现象对甲的观点进行反驳,依据的实验现象是反应后上层为淡绿色溶液;
(4)①丙过滤I中的蓝色沉淀,洗涤,取最后一次洗涤液于试管中,滴加HNO3酸化的AgNO3溶液,无白色沉淀产生,证明已洗涤干净;
②丙预测产物是Cu2O,检验方法是:取砖红色沉淀,洗涤后,加入适量H2SO4溶液,产生紫红色固体,溶液变蓝;
(5)由(4)中实验现象可知,Cu(OH)2悬浊液与SO2发生反应的化学方程式是3Cu(OH)2+SO2=Cu2O+CuSO4+3H2O。


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】已知2A2(g)+B2(g)![]() 2C(g) ΔH=-a kJ·mol-1(a > 0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为w mol·L-1,放出热量b kJ。
2C(g) ΔH=-a kJ·mol-1(a > 0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为w mol·L-1,放出热量b kJ。
(1)a___(填“>”“=”或“<”)b。
(2)若将反应温度升高到700 ℃,该反应的平衡常数将__(填“增大”“减小”或“不变”)。
(3)若在原来的容器中,只加入2 mol C,500 ℃时充分反应达到平衡后,吸收热量c kJ,C的浓度___(填“>”“=”或“<”)w mol·L-1。
(4)能说明该反应已经达到平衡状态的是___。(填序号,下同)
a.v(C)=2v(B2) b.容器内压强保持不变
c.v逆(A2)=2v正(B2) d.容器内气体的密度保持不变
(5)使该反应的反应速率增大,且平衡向正反应方向移动的操作是___;能使B的转化率增大的操作是________;使平衡向逆反应方向移动的操作是________。
a.及时分离出C气体 b.适当升高温度
c.增大B2的浓度 d..选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,水的电离达到平衡:H2O![]() H++OH-,下列叙述正确的是( )
H++OH-,下列叙述正确的是( )
A. 将纯水加热到95 ℃时,KW变大,pH不变,水仍呈中性
B. 向纯水中加入少量NaOH溶液,平衡逆向移动, KW变小
C. 向纯水中加入少量盐酸,平衡逆向移动,c(H+)增大,KW不变
D. 向纯水中加入醋酸钠,平衡正向移动,KW增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业利用海水提镁的流程如下图所示。

下列说法不正确的是
A. 海水蒸发的目的是富集
B. 石灰乳向Mg(OH)2转化说明Mg(OH)2的溶解度更小
C. MgCl2·6H2O加热脱水制MgCl2需在HCl气氛中,防止MgCl2水解
D. 电解熔融MgCl2时,阳极有金属Mg析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探讨化学平衡移动原理与氧化还原反应规律的联系,实验如下。

下列说法不正确的是
A. 试管i溶液变蓝证明有I2生成
B. 结合试管i、ii中现象,可知2Fe3++2I-![]() 2Fe2++I2
2Fe2++I2
C. 试管iii中溶液褪色说明I2转化为I-,此时I-还原性强于Fe2+
D. 对比实验I和试管iii中现象,说明物质的氧化性与还原性强弱受浓度影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有反应:Fe2O3+2Al![]() Al2O3+2Fe。
Al2O3+2Fe。
(1)___元素的化合价升高,则该元素的原子___电子,被___(填“氧化”或“还原”);而___元素的化合价降低,则该元素的原子___电子,被___(填“氧化”或“还原”)。
(2)该反应中Fe2O3发生了___反应,Al发生了__反应;___是氧化剂,__是还原剂,___是氧化产物,___是还原产物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物在氧气中充分燃烧,生成的CO2和H2O的物质的量之比为1:2,则
A. 分子中C、H、O个数之比为1:2:3 B. 分子中C、H个数之比为1:2
C. 分子中可能含有氧原子 D. 此有机物的最简式为CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在日常生活和生产中有着重要的应用。下列说法不正确的是( )
A. 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B. 某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为溶液中的SO32-水解
C. 将饱和FeCl3溶液滴入沸水中可制备Fe(OH)3胶体,利用的是盐类水解原理
D. 配制FeCl3溶液时加入少量的盐酸,抑制Fe3+水解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com