
【题目】25 ℃时,水的电离达到平衡:H2O![]() H++OH-,下列叙述正确的是( )
H++OH-,下列叙述正确的是( )
A. 将纯水加热到95 ℃时,KW变大,pH不变,水仍呈中性
B. 向纯水中加入少量NaOH溶液,平衡逆向移动, KW变小
C. 向纯水中加入少量盐酸,平衡逆向移动,c(H+)增大,KW不变
D. 向纯水中加入醋酸钠,平衡正向移动,KW增大
科目:高中化学 来源: 题型:
【题目】现有m g某气体,它由双原子分子构成,它的摩尔质量为M g/mol。若阿伏加德罗常数用NA表示,则:
(1)该气体所含原子总数为_________________个。
(2)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为____________。(水的密度为1g/mL)
(3)该气体溶于水后形成V L溶液,其溶液的物质的量浓度为_________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL0.3mol/LNa2SO4溶液和100mL0.2mol/LAl2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度约为:( )
A. 0.2mol/LB. 0.25mol/LC. 0.45mol/LD. 0.50mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应H2(g)+I2(g)![]() 2HI(g) ΔH<0,在一带有活塞的密闭容器中达到平衡,下列说法不正确的是 ( )
2HI(g) ΔH<0,在一带有活塞的密闭容器中达到平衡,下列说法不正确的是 ( )
A. 恒温,压缩体积,平衡不移动,颜色加深
B. 恒压,迅速充入HI,开始时正反应速率减小
C. 恒容,升温逆反应速率增大,正反应速率减小
D. 恒容,充入H2,I2转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修5:有机化学基础)
芳香烃A可以合成扁桃酸,也可以合成H。以下是合成线路(部分产物、反应条件已略去):

已知:
I、
II、![]()
III、
IV、D的相对分子质量为137,且在苯环的对位上有两个取代基
V、E为一溴取代物
请回答下列问题:
(1)扁桃酸中含氧官能团的名称是 ________;物质B的结构简式 ________。
(2)上述①~⑥反应中属于取代反应的是 ________(填序号)。
(3)关于H物质,下列说法正确的是 ________ (填字母序号)。
A.所有碳原子可能处于同一平面
B.可以发生加成反应、聚合反应、氧化反应和还原反应
C.H与G都能与新制Cu(OH)2反应
(4)写出反应⑥的化学方程式 ________。
(5)X是扁桃酸的同分异构体,1 mol X可与2 mol Na2CO3反应,其核磁共振氢谱有四组峰,峰面积之比为3:2:2:1,其结构简式为 ________ (任写两种)。
(6)请结合所学知识和上述信息,写出由A和乙醛为原料(无机试剂任用)制备肉桂醛(![]() )的合成路线流程图 ________。
)的合成路线流程图 ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298 K时,在20.0 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol·L-1氨水的电离度为1.32%,下列有关叙述不正确的是( )

A. 该滴定过程应选择甲基橙作为指示剂
B. M点对应的盐酸体积小于20.0 mL
C. M点: c(NH4+)+ c(NH3·H2O) =c(Cl-)
D. M点处的溶液中c(NH4+)=c(Cl-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)恒温下,向一个2L的恒容密闭容器中充入1 molN2和2.6 molH2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示。
时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
c(NH3)/(mol·L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①前20min的平均速率ν(H2)为__________,该温度下此反应化学平衡平衡常数为_________。
②能提高反应中N2的平衡转化率的是___________。
A.增加N2的浓度 B.增加H2的量 C.移出部分NH3
D.提高反应温度 E.加入合适的催化剂
(2)工业合成氨的反应为:N2(g)+3H2(g)![]() 2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的恒容密闭容器中达到平衡后。改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是___________________。
2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的恒容密闭容器中达到平衡后。改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是___________________。
A、充入氦气增大压强 B、增大反应物的浓度 C、使用催化剂 D、降低温度
(3)已知某化学反应的平衡常数表达式为K=[CO2]·[H2]/[CO]·[H2O],在不同的温度下该反应的平衡常数如下表:
t℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
该反应的化学方程是_________________________________;若在1 L的密闭容器中通入CO2和H2各1 mol,5 min后温度升高到830℃,此时测得CO2为0.4 mol,该反应__________达到平衡状态(填是或否)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组欲探究SO2与Cu(OH)2 的反应。
实验 | 实验步骤 | 现象 |
| 步骤1:打开分液漏斗,向烧瓶中加入30mL 0.5 mol/LNaOH溶液 | I. 有蓝色絮状沉淀,静置后分层。 |
步骤2:从左侧导管通入SO2气体 | II. 静置后分层,上层溶液为淡绿色,底部有白色沉淀 |
(1)现象I中产生蓝色沉淀的离子方程式是___________。
(2)甲为了确认现象II中白色沉淀的成分,进行如下探究。查阅资料:
CuSO3 | CuCl | Cu2O | |
溶解性 | 不溶于水,浅黄色沉淀 | 不溶于水,白色沉淀 | 不溶于水,砖红色沉淀 |
性质 | 与酸反应 | 能溶于较浓的HCl溶液 | 酸性体系中不稳定,进一步反应生成Cu和Cu2+ |
并进行如下实验:
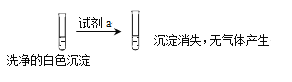
①试剂a是___________。
②现象II中生成白色沉淀的离子方程式是___________。
(3)甲认为Cu(OH)2沉淀全部转化为CuCl,乙依据实验现象对甲的观点进行反驳,依据的实验现象是_________。
(4)丙认为实验存在干扰,欲探究纯净的Cu(OH)2 悬浊液与SO2的反应。
①丙过滤I中的蓝色沉淀,洗涤,取最后一次洗涤液于试管中,_________(填操作和现象),证明已洗涤干净。再进行如下实验:
实验 | 实验步骤 | 现象 |
| 从左侧导管通入SO2气体 | III. 静置后分层,上层溶液为淡绿色,底部有砖红色沉淀。 |
②丙预测产物是Cu2O,取砖红色沉淀,洗涤后,_________(填操作和现象),证明产物是Cu2O。
(5)纯净的Cu(OH)2 悬浊液与SO2发生反应的化学方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+2H2O,该反应的还原剂是____,当1 mol O2发生反应时,还原剂所失电子的物质的量为_____mol, 其中被S 元素还原的O2的物质的的量为__________mol 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com