
(14分) A、B、C、D、E是位于短周期的主族元素。已知:①热稳定性:HmD>HmC;② 、
、 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④ A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④ A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
(1)HmDm的电子式___________________。
(2) 、
、 的还原性强弱顺序为:_________,(用离子符号表示)能证明其还原性强弱的离子方程式为________________________________。
的还原性强弱顺序为:_________,(用离子符号表示)能证明其还原性强弱的离子方程式为________________________________。
(3)将E的单质通入A与D形成的化合物的水溶液中,在常温下反应的离子方程式为:
_____________________________________。
(4)常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液按体积比1:2混合,写出该反应的离子方程式 。该溶液的溶质含有的化学键类型是
(5)在A、B、C、E单质中,符合下列转化关系的是_____________(填元素符号)。

(1) 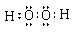 (2分)
(2分)
(2) S2->Cl- (2分),Cl2 + S2-= 2Cl-+ S↓ (2分)
(3) Cl2 + 2OH-= Cl-+ ClO-+ H2O(2分)
(4) H2 S+ 2OH-= S2-+ H2O (2分) 离子键(2分)
(5) Na、S(2分)
【解析】根据热稳定性:HmD>HmC可知,DC属于同一主族的非金属,且D位于C的上一周期。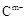 、
、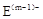 具有相同的电子层结构,说明E位于C的右侧。A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小,说明A是第IA元素,B是第ⅢA元素。在短周期中只有Na和Al符合,A与B质子数之和是D质子数的3倍,所以D是O,则C是S,E是Cl。
具有相同的电子层结构,说明E位于C的右侧。A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小,说明A是第IA元素,B是第ⅢA元素。在短周期中只有Na和Al符合,A与B质子数之和是D质子数的3倍,所以D是O,则C是S,E是Cl。
(1)HmDm是双氧水,电子式为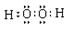 。
。
(2)同周期元素自左向右非金属性逐渐增强,相应离子的还原性逐渐减弱,即S2->Cl-。可以利用单质间的相互置换来验证,方程式为Cl2+S2-=2Cl-+S↓。
(3)E单质是氯气,A与D形成的化合物的水化物是氢氧化钠,所以方程式为Cl2 + 2OH-= Cl-+ ClO-+ H2O。
(4)氢硫酸是二元酸,与强碱反应会生成正盐或算式盐,因为二者的物质的量是1︰2,因而产物是硫化钠,方程式为H2 S+ 2OH-= S2-+ H2O。
(5)由转化特点可知,单质是连续被氧气氧化,符合条件的是钠和硫。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
| 氟化物 | X | Y | Z |
| 熔点/K | 1266 | 1534 | 183 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com