
����Ŀ����Cl2����ijЩ�����л���ʱ�����������HCl�����÷�ӦA����ʵ���ȵ�ѭ�����á�
��ӦA��4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
��֪��I����ӦA�У�4molHCl���������ų�115.6kJ������
II��
�ж�����˵����ȷ���ǣ� ��
A. ��ӦA����H����115.6kJ��mol��1
B. H2O��H��O����HCl��H��Cl����
C. ��II�е������ж���Ԫ�صķǽ����Ա���Ԫ��ǿ
D. �Ͽ�1molH��O����Ͽ�1molH��Cl�������������31.9kJ
���𰸡�D
�����������������A����ӦA����H=-115.6kJ/mol��A����B��E(H-O)��E(HCl)�ֱ��ʾH-O���ܡ�H-Cl���ܣ���ӦA�У�4mol HCl���������ų�115.6kJ����������Ӧ����H=��Ӧ���ܼ���-��������ܼ��ܣ��ʣ�4��E(H-Cl)+498kJ/mol-[2��243kJ/mol+4��E(H-O)]=-115.6kJ/mol�������ã�4E(H-Cl)-4E(H-O)=-127.6kJ/mol����E(H-O)-E(HCl)=31.9kJ/mol��H2O��H��O����HCl��H��Cl��ǿ��B����C���ɷ�Ӧ���жϣ������ܹ���������Ϊ��������Ԫ�صķǽ����Ա���Ԫ������C����D��E(H-O)��E(HCl)�ֱ��ʾH-O���ܡ�H-Cl���ܣ���ӦA�У�4mol HCl���������ų�115.6kJ����������Ӧ����H=��Ӧ���ܼ���-��������ܼ��ܣ��ʣ�4��E(H-Cl)+498kJ/mol-[2��243kJ/mol+4��E(H-O)]=-115.6kJ/mol�������ã�4E(H-Cl)-4E(H-O)=-127.6kJ/mol����E(H-O)-E(HCl)=31.9kJ/mol���ʶϿ�1mol H-O����Ͽ�1mol H-Cl�������������ԼΪ31.9kJ/mol��1mol=31.9kJ��D��ȷ����ѡD��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬŨ�ȵ�������п��Ӧʱ��������Ա���ԭΪSO2��Ҳ�ɱ���ԭΪH2��Ϊ����֤��һ��ʵ��ijͬѧ������ͼ��ʾװ�ý���ʵ�飨ʵ��ʱѹǿΪ101 kPa���¶�Ϊ0 �棩��
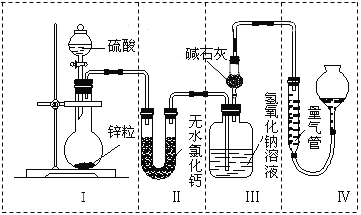
��1��������ƿ�з���0.65 gп������c mol��L��1��H2SO4��Ӧ��Ϊ��֤ʵ����۵Ŀɿ��������ܵ����˹����_________________��
A��200 mL B��300 mL C��400 mL
��2����0.65gп����ȫ�ܽ⣬װ�â� ����0.64 g����Բ����ƿ�з�����Ӧ�Ļ�ѧ����ʽΪ______��
��3������ƿ��Ͷ��a gп����ȫ��Ӧ����������ϴ��ƿ����b g�����������ռ���V mL���壬���У�a g��65 g��mol��1��2��b g��64 g��mol��1��2+V mL��22400 mL��mol��1��2���õ�ʽ���ݵ�ԭ����________��
��4��������ƿ��Ͷ��10gп������һ������18 mol��L��1Ũ����10 mL����ַ�Ӧ��п��ʣ�࣬���װ�â� ����3.2 g��������ʵ����̲����������У�m(SO2)/m(H2)=_____��������װ�â���ʢ����ˮ�Ȼ��Ƶ�U�ιܣ�m(SO2) / m(H2)����ֵ��________���ƫ����ƫС������Ӱ�족����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݱ�����ij��������к���һ�ֳ�Ϊ���ʣ�COS���Ļ��������ӽṹ�������̼���ƣ�����������ȼ�ա����й������ʵ�˵����ȷ���ǣ� ��
A.������̼�ǷǼ��Է��ӣ���������Ҳ�ǷǼ��Է���
B.������̼�����ʾ���ԭ��
C.����������ԭ�Ӿ���
D.���ʷ����е�����ԭ�Ӵ���ͬһֱ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ��X��Y����ɻ�ѧʽΪXY2�����ӻ������X��Y��ԭ������������
A. 11��16 B. 6��8 C. 12��17 D. 20��8
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ���Ǹ����ں�ˮ�е���ʴ���̣������й�˵����ȷ����(����)

A. �ý�����ʴ����Ϊ���ⸯʴ
B. ����ΪC�������ķ�ӦΪ������Ӧ
C. �����������·�������������ʴ
D. ������ӦΪO2��2H2O��4e��===4OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�����ͼ��ʾ�绯ѧװ�õķ�����ȷ����

A. ��XΪֱ����Դ��YΪͭ������������Fe���϶�ͭ
B. ��XΪֱ����Դ��YΪ̼���Ӹ�������Fe��������
C. ��XΪ�����ƣ�YΪп������SO42������Fe��
D. ��XΪ���ߣ�YΪͭ������Fe��������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I. ��ѧʵ����ͻ�����Ч�ؼ�����Ⱦ��ʵ�ֻ�ѧʵ����ɫ����Ҫ��
ijͬѧ�����в�����һ��ʵ�飺��һ���³İ�ֽ�IJ���Ƭ�IJ�ͬλ�÷ֱ�μ�Ũ��Ϊ0.1 mol��L��1��KBr��Һ��KI(������)��Һ��NaOH(����̪)��Һ��FeCl2(��KSCN)��Һ��1�Σ�ÿ��Һ�α˴˷ֿ���Χ�ɰ뾶С�ڱ������Բ��(��ͼ��ʾ)����Բ��e������2��֥������С��KMnO4���壬��KMnO4����μ�һ��Ũ���ᣬ��������������Ǻá�
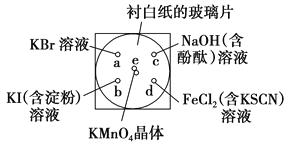
(1)e����Ӧ�����ӷ���ʽΪ____________________________��
(2)b����ʵ������Ϊ_________________________________________��
(3)c����Ӧ�Ļ�ѧ����ʽΪ____________________________________________��
��״���£�����0.224 L Cl2��NaOH��Һ���պ�ת�Ƶ��ӵ����ʵ���Ϊ________mol��
(4)ͨ����ʵ���ܷ�Ƚ�Cl2��FeCl3��KMnO4�������������Ե�ǿ����________(��ܡ����ܡ�)�����ܣ�����������ǿ������˳����________________��
II. �ݱ�������һ��ϸ�������������ڵ�������Һ�У��ɽ���ͭ��CuFeS2�����������Σ�4CuFeS2��2H2SO4��17O2===4CuSO4��2Fe2(SO4)3��2H2O�����÷�Ӧ�����Һ�����������̿��Ʊ�����(CuSO4��5H2O)��
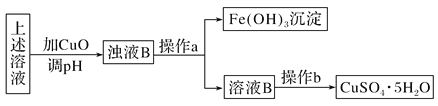
�ټ�����ҺB��Fe3���Ƿ�����ʵ�鷽��
_________________________________________________________________��
����ʵ�����У��������ԭ����ͬ�ķ���������ҺB����������ͭ(Ҫ��һ�ַ���ֻ��һ����Ӧ�����)��д�����ַ������漰�Ļ�ѧ����ʽ��
����һ��_________________________________________________________��
��������_________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҿ�������غ�Ũ���ᷴӦ����ȡ��������Ӧ����ʽ���£�KClO3 + 6HCl��Ũ��== KCl + 3Cl2��+ 3H2O
��1���÷�Ӧ�з�����ԭ��Ӧ��������__________������������___________��
��2������0.2mol���ӷ���ת��ʱ�����ɵ����������Ϊ________L����״��������������HCl�����ʵ���Ϊ______mol��
��3�������ɵ�����ͨ�뵽ʯ�����У�������ǡ�÷�Ӧʱ�����Ƶ�Ư��_________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������10mL 0.1mol/L���ᣨHCOOH����Һ����μ���һ��Ũ�ȵ��ռ���Һ�������Һ���¶ȱ仯��ͼ��ʾ������˵����ȷ����
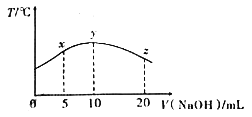
A. ���ռ���Һ�����ʵ���Ũ��Ϊ0.01mol/L
B. x����Һ�д��ڣ�2c(Na+)=c(HCOO-)+c(HCOOH)
C. y��ʱ������ĵ���ƽ�ⳣ���������Һ������
D. ��y�㵽z�㣬�����Һ��һֱ���ڣ�c(Na+)��c(HCOO-)>c(OH-)>c(H+)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com