
����Ŀ����ͬŨ�ȵ�������п��Ӧʱ��������Ա���ԭΪSO2��Ҳ�ɱ���ԭΪH2��Ϊ����֤��һ��ʵ��ijͬѧ������ͼ��ʾװ�ý���ʵ�飨ʵ��ʱѹǿΪ101 kPa���¶�Ϊ0 �棩��
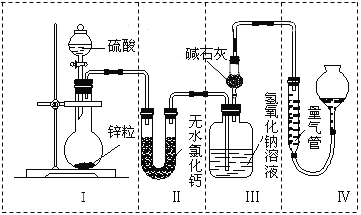
��1��������ƿ�з���0.65 gп������c mol��L��1��H2SO4��Ӧ��Ϊ��֤ʵ����۵Ŀɿ��������ܵ����˹����_________________��
A��200 mL B��300 mL C��400 mL
��2����0.65gп����ȫ�ܽ⣬װ�â� ����0.64 g����Բ����ƿ�з�����Ӧ�Ļ�ѧ����ʽΪ______��
��3������ƿ��Ͷ��a gп����ȫ��Ӧ����������ϴ��ƿ����b g�����������ռ���V mL���壬���У�a g��65 g��mol��1��2��b g��64 g��mol��1��2+V mL��22400 mL��mol��1��2���õ�ʽ���ݵ�ԭ����________��
��4��������ƿ��Ͷ��10gп������һ������18 mol��L��1Ũ����10 mL����ַ�Ӧ��п��ʣ�࣬���װ�â� ����3.2 g��������ʵ����̲����������У�m(SO2)/m(H2)=_____��������װ�â���ʢ����ˮ�Ȼ��Ƶ�U�ιܣ�m(SO2) / m(H2)����ֵ��________���ƫ����ƫС������Ӱ�족����
���𰸡� B Zn��2H2SO4(Ũ)��ZnSO4��SO2����2H2O ת�Ƶ����غ� 20��1 ƫ��
�������������������1�����ݵ����غ㣬0.65 gп����H2SO4��Ӧ�����������0.01mol����״���������224mL����2����0.65gп����ȫ�ܽ⣬��������������ʵ�����0.01mol��װ�â� �������������ն�������װ�â�����0.64 g��˵����Ӧ���ɶ�������0.64g���������������ʵ���=![]() ��˵����Ӧֻ���ɶ����������塣
��˵����Ӧֻ���ɶ����������塣
��3������ƿ��Ͷ��a gп����ȫ��Ӧ����������ϴ��ƿ����b g�����������ռ���V mL���壬����ת�Ƶ����غ��У�a g��65 g��mol��1��2��b g��64 g��mol��1��2+V mL��22400 mL��mol��1��2��
��4��������ƿ��Ͷ��10gп������һ������18 mol��L��1Ũ����10 mL����ַ�Ӧ��п��ʣ�࣬���װ�â� ����3.2 g�����ɶ�����������ʵ���=![]() ������Zn��2H2SO4(Ũ)��ZnSO4��SO2����2H2O���÷�Ӧ��������0.1mol������ʵ�������������18 mol��L��1��0.01L=0.18mol������Zn��H2SO4��ZnSO4��H2����������Ϊ0.08mol����������0.08mol��������װ�â���ʢ����ˮ�Ȼ��Ƶ�U�ιܣ�������������װ�â��лӷ���ˮ�����m(SO2)����ƫ��
������Zn��2H2SO4(Ũ)��ZnSO4��SO2����2H2O���÷�Ӧ��������0.1mol������ʵ�������������18 mol��L��1��0.01L=0.18mol������Zn��H2SO4��ZnSO4��H2����������Ϊ0.08mol����������0.08mol��������װ�â���ʢ����ˮ�Ȼ��Ƶ�U�ιܣ�������������װ�â��лӷ���ˮ�����m(SO2)����ƫ��
��������1�����ݵ����غ㣬0.65 gп����H2SO4��Ӧ�����������0.01mol����״���������224mL��Ϊ��֤ʵ����۵Ŀɿ��������ܵ����˹����300 mL��
��2��0.65gп����ȫ�ܽ⣬��������������ʵ�����0.01mol��װ�â� �������������ն�������װ�â�����0.64 g��˵����Ӧ���ɶ�������0.64g���������������ʵ���=![]() ��˵����Ӧֻ���ɶ����������壬��Ӧ����ʽΪZn��2H2SO4(Ũ)��ZnSO4��SO2����2H2O��
��˵����Ӧֻ���ɶ����������壬��Ӧ����ʽΪZn��2H2SO4(Ũ)��ZnSO4��SO2����2H2O��
��3������ƿ��Ͷ��a gп����ȫ��Ӧ����������ϴ��ƿ����b g�����������ռ���V mL���壬����ת�Ƶ����غ��У�a g��65 g��mol��1��2��b g��64 g��mol��1��2+V mL��22400 mL��mol��1��2�����Ըõ�ʽ���ݵ�ԭ����ת�Ƶ����غ㡣
��4��������ƿ��Ͷ��10gп������һ������18 mol��L��1Ũ����10 mL����ַ�Ӧ��п��ʣ�࣬���װ�â� ����3.2 g�����ɶ�����������ʵ���=![]() ������Zn��2H2SO4(Ũ)��ZnSO4��SO2����2H2O���÷�Ӧ��������0.1mol������ʵ�������������18 mol��L��1��0.01L=0.18mol������Zn��H2SO4��ZnSO4��H2����������Ϊ0.08mol����������0.08mol������������0.16g��m(SO2)/m(H2)=3.2g/0.16g=20��1��������װ�â���ʢ����ˮ�Ȼ��Ƶ�U�ιܣ�������������װ�â��лӷ���ˮ�����m(SO2)����ƫ��, m(SO2) / m(H2)����ֵ��ƫ��
������Zn��2H2SO4(Ũ)��ZnSO4��SO2����2H2O���÷�Ӧ��������0.1mol������ʵ�������������18 mol��L��1��0.01L=0.18mol������Zn��H2SO4��ZnSO4��H2����������Ϊ0.08mol����������0.08mol������������0.16g��m(SO2)/m(H2)=3.2g/0.16g=20��1��������װ�â���ʢ����ˮ�Ȼ��Ƶ�U�ιܣ�������������װ�â��лӷ���ˮ�����m(SO2)����ƫ��, m(SO2) / m(H2)����ֵ��ƫ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���Ԫ�أ���ԭ�Ӱ뾶���μ�С��Ԫ�ص�һ�����������ߵ�˳�����е��ǣ� ��
A. K��Na��Li B. N��O��C C. Cl��S��P D. Al��Mg��Na
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ˮ��Ӧ������ˮú����������壩���䷴Ӧ����ʾ��ͼ��ͼ��ʾ������������ʾ��ͼ�ó��Ľ����У���ȷ����( )

A. ��Ӧǰ���Ԫ�صĻ��ϼ۾�����
B. ˮú���ijɷ���һ����̼������
C. �÷�Ӧ�к���Ԫ�صĻ�������3��
D. �÷�Ӧ�Ļ�ѧ����ʽ�м����ˮ�ļ�����֮��Ϊ1�U1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������۷����Ȼ�����Һ�У���ȫ��Ӧ��������Һ��Fe2+��Fe3+�����ʵ���Ũ��֮��Ϊ1��2�����ѷ�Ӧ��Fe3+��δ��Ӧ��Fe3+�����ʵ���֮��Ϊ�� ��
A��1��1 B��1��2 C��1��3 D��2��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������ÿ���4��22�գ���һ�������ԵĻ����������������Ϊ�в����ڻ����������ǣ� ��
A. �ϸ����С������鶨�顷����������������ŷ�
B. ��������ú��ʯ�ͼ���Ȼ�������㹤ҵ��չ����Ҫ
C. ��ǿ����Դ�о���ʹ��ѹ����Ȼ��������������ȼ��
D. �з��ɽ������ϻ����Ʒ�����ư�ɫ��Ⱦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������±��ṩ�IJ����������Dz���������ѡ����ʵ��װ�þ��ܴﵽ��Ӧʵ��Ŀ�ĵ���
ѡ�� | A | B | C | D |
ʵ��Ŀ�� | ��ȥKCl������MnO2 | ��10 mol��L-1��������100mL0.1 mol��L-1���� | �ú�������NH4Cl���ʵ�NaCl��Һ�Ʊ��Ȼ��ƾ��� | ����Ȳ�ķ���װ�� |
ʵ��������װ�� | �ձ�������������Һ©�� | 100 mL����ƿ�����������ձ� |
|
|
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��ж�Ӧ��ϵ�������(����)
A | NaCl===Na����Cl���� NH3��H2O | �����ڵ��뷽��ʽ |
B | Ba2����SO42-===BaSO4���� HCO3-��OH��===CO32-��H2O | ���ɱ�ʾһ�෴Ӧ |
C | SO2ʹ���Ը��������Һ��ɫ��SO2ʹ���Է�̪��Һ��ɫ | ������SO2��ͬһ���� |
D | Cl2��2NaOH===NaCl��NaClO��H2O�� 3S��6NaOH===2Na2S��Na2SO3��3H2O | Cl2��S�ڷ�Ӧ�м���������������ԭ�� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(Fr)Ԫ�������ڱ���λ�ڵ������ڣ���IA�壬�����������ڱ��е�λ���Ʋ������ʣ����д������
A. �䵥�ʵ��۵���Ƶ��۵�� B. ���������Ӧ��ˮ����ļ��Ժ�ǿ
C. ��ԭ�Ӱ뾶��ͬһ������������ D. �ڿ�����ȼ��ֻ������Fr2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Cl2����ijЩ�����л���ʱ�����������HCl�����÷�ӦA����ʵ���ȵ�ѭ�����á�
��ӦA��4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
��֪��I����ӦA�У�4molHCl���������ų�115.6kJ������
II��
�ж�����˵����ȷ���ǣ� ��
A. ��ӦA����H����115.6kJ��mol��1
B. H2O��H��O����HCl��H��Cl����
C. ��II�е������ж���Ԫ�صķǽ����Ա���Ԫ��ǿ
D. �Ͽ�1molH��O����Ͽ�1molH��Cl�������������31.9kJ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com