
【题目】甲烷和水反应可以制水煤气(混合气体),其反应的微观示意图如图所示,根据以上微观示意图得出的结论中,正确的是( )

A. 反应前后各元素的化合价均不变
B. 水煤气的成分是一氧化碳和氧气
C. 该反应中含氢元素的化合物有3种
D. 该反应的化学方程式中甲烷和水的计量数之比为1︰1
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.CaO+H2O=Ca(OH)2可放出大量热,可利用该反应设计原电池,把化学能转化为电能
B.任何化学反应中的能量变化都表现为热量变化
C.化学反应一定有化学键断裂,有化学键断裂一定发生化学反应
D.灼热的铂丝与NH3、O2混合气接触,铂丝继续保持红热,说明氨的氧化反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列仪器:

(1)海水蒸馏是由海水获得淡水的常用方法之一,在实验室里组成一套蒸馏装置肯定 需要上述仪器中的一部分,按照实验仪器从下到上、从左到右的顺序,依次是__________ (填序号);仪器⑤的冷凝水应从________(填“a”或“b”)口进入。
(2)海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述仪器 中的______(填序号),该仪器名称为__________,向该碘水中加入四氯化碳以提取碘 单质的实验操作叫做_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 由NaH2PO2是正盐可推知H3PO2是一元酸
B. 由同种元素组成的物质一定是纯净物
C. 直径介于1~100nm之间的微粒称为胶体
D. 不能与酸反应生成盐和水的氧化物,能够与碱反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各有机物的数目与分子式C4H7ClO2且能与NaHCO3溶液反应生成CO2的有机物的数目(不考虑立体异构)相同的是
A. 分子式为C5H10的烯烃 B. 甲苯的一氯代物
C. 相对分子质量为74的一元醇 D. 立方烷(![]() )的二硝基取代物
)的二硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废料料中含有Cr(OH)3、Al2O3、CuO、NiO等物质,工业上通过下列流程回收其中有用的金属和制取Na2Cr2O7。
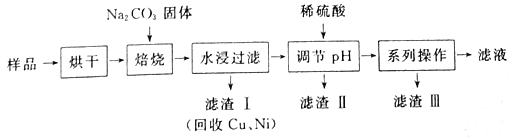
已知:
①“水浸过滤”后的溶液中存在Na2CrO4、NaAlO2等物质
②除去滤渣II后,溶液中存在反应2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
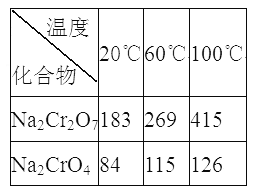
③Na2Cr2O7、Na2CrO4在不同温度下的溶解度(g/100 g H2O)如下表:
(1) “焙烧”过程中生成NaAlO2化学方程式为_____________________。
(2)生成滤渣II时,需加入适量稀硫酸调节溶液的pH除去A1O2-。若稀硫酸过量,则过量后引起反应的离子方程式为______________________。
(3) “系列操作”为:继续加入稀硫酸、_____、冷却结晶、过滤。继续加入稀硫酸的目的是_____________,滤渣III的主要成分是_________(填化学式)。
(4)工业上还可以在“水浸过滤’’后的溶液中加人适量稀硫酸,用石墨作电极电解生产金属铬,阴极的电极反应式为______________。
(5)流程图最后的“滤液”中仍然有残留的Na2Cr2O7。Cr为重金属元素,若含量过高就排入河流中,会对河水造成重金属污染。为测定“滤液”中的c(Na2Cr2O7),某实验小组取“滤液”20mL,水稀释至250 mL,再取稀释后的溶液25 mL于锥形瓶中,用c mol L-1的FeSO4溶液进行氧化还原滴定,到终点时消耗FeSO4溶液体积为V mL,则“滤液”中的c(Na2Cr2O7)=______mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中的杂质,所用试剂和方法不正确的是
物质 | 杂质 | 除杂质所用试剂和方法 | |
A | KCl溶液 | I2 | CCl4,萃取分液 |
B | CO2 | HCl | 饱和NaHCO3溶液,洗气 |
C | CaCO3 | CaO | 盐酸,过滤 |
D | Mg粉 | A1粉 | NaOH溶液,过滤 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为H2。为了验证这一事实,某同学拟用如图所示装置进行实验(实验时压强为101 kPa,温度为0 ℃)。
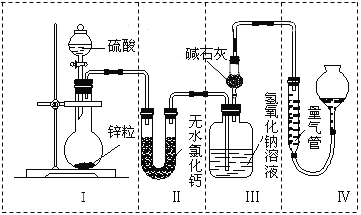
(1)若在烧瓶中放入0.65 g锌粒,与c mol·L-1的H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是_________________。
A.200 mL B.300 mL C.400 mL
(2)若0.65g锌粒完全溶解,装置Ⅲ 增重0.64 g,则圆底烧瓶中发生反应的化学方程式为______;
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g,量气管中收集到V mL气体,则有:a g÷65 g·mol-1×2=b g÷64 g·mol-1×2+V mL÷22400 mL·mol-1×2,该等式依据的原理是________;
(4)若在烧瓶中投入10g锌,加入一定量的18 mol·L-1浓硫酸10 mL,充分反应后锌有剩余,测得装置Ⅲ 增重3.2 g,则整个实验过程产生的气体中,m(SO2)/m(H2)=_____;若撤走装置Ⅱ中盛有无水氯化钙的U形管,m(SO2) / m(H2)的数值将________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,某星球大气中含有一种称为硫化羰(COS)的化合物,其分子结构与二氧化碳类似,能在氧气里燃烧。下列关于硫化羰的说法正确的是( )
A.二氧化碳是非极性分子,所以硫化羰也是非极性分子
B.二氧化碳与硫化羰均无还原性
C.固体硫化羰是原子晶体
D.硫化羰分子中的三个原子处于同一直线上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com