
����Ŀ�����������ڹ�ũҵ��ҽѧ������й㷺��Ӧ�á������ǹ�ҵ���Ʊ��������ص����ַ������ش��������⣺
��ֱ�ӷ�

��1������XΪ___���ѧʽ����
��2����ת�������跢����Ӧ�����ӷ�Ӧ����ʽ___����֪��Ca3(PO4)2������ˮ����
��3����Һ���м���״���������___��
��4������������___��
������кͷ�
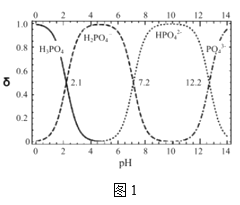
��5������������Һ��ߴ��������ڷ�Ӧ���з����кͷ�Ӧ�Ʊ��������ء�д���˷�Ӧ�����ӷ�Ӧ����ʽ___����ͼ1�ж��Ʊ��������أ���80%�������pH��Χ___��
��ⷨ
��ⷨ��ȡKH2PO4��ԭ����ͼ2��ʾ��һ�����£����ɵõ�NaClO3��
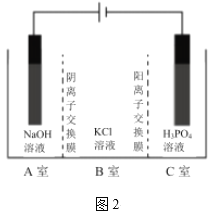
��6����___�ң����ţ��ɵõ�KH2PO4��д������ClO3�����ĵ缫��Ӧʽ___��
���𰸡�HCl Ca3(PO4)2+4H++3SO42��![]() 2H2PO4��+3CaSO4 �ٽ��������ص����� ���� OH��+H3PO4=H2PO4��+H2O 3��6.5 C Cl��+6OH����6e��=ClO3��+3H2O
2H2PO4��+3CaSO4 �ٽ��������ص����� ���� OH��+H3PO4=H2PO4��+H2O 3��6.5 C Cl��+6OH����6e��=ClO3��+3H2O
��������
Ũ������Ȼ���180��C������Ӧ�����Ȼ��������������أ���ˮϡ�͵õ�������ص���Һ�������������70��Cת��Ϊ�������ƺ�����ƣ����˺����Һ����״��ٽ��������ص���������Һ��������غͼ״�������õ��״�������أ�
��(1)�����̿�֪��KCl��Ũ����õ�KHSO4������Ԫ���غ������
(2)Ũ������Ȼ��ؼ��ȷ�Ӧ�������Ȼ������壬�ٽ���Ӧ������У�
(3)�����̿�֪KHSO4��Һ����Ca3(PO4)270�����ת���õ�KH2PO4����һ����ΪCaSO4���ݴ���д��
(4)��Һ���м���״��õ���Ʒ�������أ��ʼ״��������Ǵٽ��������ص�������
(5)�������������ӷ����ѻӷ������ʣ��ݴ˷�����
��(6)����������Һ��ߴ��������ڷ�Ӧ���з����кͷ�Ӧ�Ʊ��������أ�ͼ�������֪��������(��80%)��pH��Χ��
��(7)C�����ӵ�Դ�����õ������������������Ӽ�����ͨ�������ӽ���Ĥ����C�ң��õ���Ʒ�������أ�������ͨ�������ӽ���Ĥ��A��ʧȥ���ӷ���������Ӧ���ݴ˷�����
��(1)�����̿�֪��KCl��Ũ����õ�KHSO4����õ�������ΪHCl��
(2)����ȡ�����裬Ũ��������KCl�ܷ�����ѧ��Ӧ��ԭ���ǣ���HCl��������ƽ��������Ӧ������У�
(3)�����̿�֪KHSO4��Һ����Ca3(PO4)270�����ת���õ�KH2PO4����һ����ΪCaSO4�����ӷ���ʽΪ��Ca3(PO4)2+4H++3SO42��![]() 2H2PO4��+3CaSO4��
2H2PO4��+3CaSO4��
(4)��Һ���м���״��õ���Ʒ�������أ��ʼ״��������Ǵٽ��������ص�������
(5)����������õ��ӷ��ļ״��͵������Һ����������ɵã�
��(6)����������Һ��ߴ��������ڷ�Ӧ���з����кͷ�Ӧ�Ʊ��������أ���Ӧ�����ӷ�Ӧ����ʽ��OH��+H3PO4��H2PO4��+H2O��ͼ�������֪�ж��Ʊ���������(��80%)�����pH��Χ��3��6.5��
��(7)C�����ӵ�Դ�����õ������������������Ӽ�����ͨ�������ӽ���Ĥ����C�ң��õ���Ʒ�������أ�������ͨ�������ӽ���Ĥ��A��ʧȥ���ӷ���������Ӧ�õ�ClO3�����缫��ӦʽΪ��Cl��+6OH����6e����ClO3��+3H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(NaNO2)��һ�ֳ��õ�ʳƷ���Ӽ���ʹ��ʱ���ϸ����������ʵ������2NO+Na2O2=2NaNO2Ϊԭ������������װ����ȡNaNO2(�гֺͼ���������)��
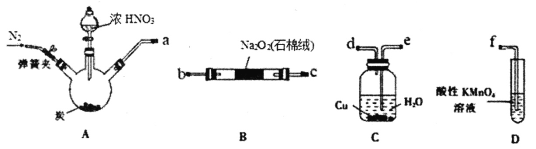
��֪��������KMnO4��Һ�ɽ�NO��NO2-����ΪNO3-��MnO4-����ԭΪMn2+��
��HNO2���в��ȶ��ԣ�2HNO2=NO2��+NO��+H2O��
�ش��������⣺
(1)�������������������ӿ�______________(��ӿ���ĸ)��
(2)ʵ�������Cװ���ڹ۲쵽��������___________________________��
(3)Na2O2��ַ�Ӧ�ⶨNaNO2��������ȡ��Ӧ��B�й�����Ʒ3.45g��������ˮ����ȴ����0.50mol�� L-1����KMnO4��Һ�ζ����ظ����Σ���Һƽ������Ϊ20.00mL��
�ٸòⶨʵ����Ҫ�õ����������е�___________(�����)��
a����ƿ b������ƿ c����ͷ�ι� d����ʽ�ζ��� e����ʽ�ζ��� f��������
�ڼٶ��������ʲ���KMnO4��Ӧ���������Ʒ��NaNO2�Ĵ���Ϊ____����
��ʵ��õ�NaNO2�ĺ�������ƫ�ͣ�������Ʒ�к��е���Ҫ����Ϊ_____(�ѧʽ)��Ϊ��߲�Ʒ��������ʵ��װ�õĸĽ�����Bװ��֮ǰ��װʢ��_____(��ҩƷ����)��______(����������)��
(4)���һ��ʵ�鷽��֤������������NaNO2����������________________________��
(�ṩ���Լ���0.10mol��L-1NaNO2��Һ��KMnO4��Һ��0.10mol��L-1KI��Һ��������Һ��ϡ���ᡢϡ����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʵ��װ�ý��е���Ӧʵ��,�ܴﵽʵ��Ŀ�ĵ���
A.����ͼ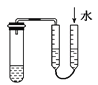 ������֤װ�õ�������
������֤װ�õ�������
B.ʵ����������ͼ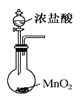 װ���Ʊ�����
װ���Ʊ�����
C.����ͼ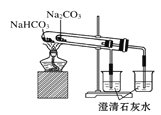 �Ƚ�̼���ƺ�̼�����Ƶ����ȶ���
�Ƚ�̼���ƺ�̼�����Ƶ����ȶ���
D.����ͼ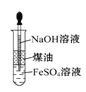 �Ʊ�Fe(OH)2���ܽϳ�ʱ��۲�����ɫ
�Ʊ�Fe(OH)2���ܽϳ�ʱ��۲�����ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��һƿ��ɫ������Һ�����п��ܺ�H+��Na+��Mg2+��Ba2+��Cl��SO42��CO32���ӡ��ֽ�������ʵ�飺
A����pH��ֽ������Һ��������Һ��ǿ���ԣ�
B��ȡ������Һ��μ���NaOH��Һ��ʹ��Һ�����Ա�Ϊ���ԣ�����������
C��ȡ����B�еļ�����Һ���μ�Na2CO3��Һ���а�ɫ����������
������������ʵȷ��������Һ�п϶����ڵ�������_________________________��
�϶������ڵ�������___________________________��
��д��C�з�����Ӧ�����ӷ���ʽ________________________________��
(2)����ԭ���������ˮ������Ӧ�Ļ�ѧ����ʽ��_____________________________��
����ȥMg���е�Al�۵��Լ���__________________����Ӧ�����ӷ���ʽΪ��___________________________________��
(3)�������ƣ�Na2FeO4������ǿ�����ԣ��ɶ�����ˮ�����������������������ƿ������������ʹ��������ڼ��Խ����з�Ӧ�õ����벹�䲢��ƽ�������ӷ���ʽ��
____Fe(OH)3 +____ClO��+____OH�� =__FeO42����___Cl��+_____ _______
(4)�ڷ�Ӧ11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4�У���������___________��
����2mol H3PO4���ɣ�ת�Ƶĵ��ӵ����ʵ���Ϊ__________________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I�����Ǽ���ʵ���г��õ�������
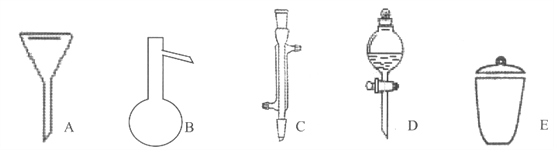
д����������������������ƣ�
A__________��B__________��C__________��D__________��E__________
IIʵ����Ҫ����100 mL 2 mol��L NaCl��Һ����ش��������⣺
��1�����ƹ�������Ҫʹ�õ���Ҫ�������������ձ�������������ͷ�ιܡ���ƽ����Ͳ��__________________��
��2����������ƽ��ȡ�Ȼ��ƹ��壬������Ϊ__________g��
��3��������Ҫ�����������ȷ˳����____________________������ţ���
�ٳ�ȡһ���������Ȼ��ƣ������ձ��У�����������ˮ�ܽ⣻
�ڼ�ˮ��Һ��������ƿ���̶�����1��2����ʱ�����ý�ͷ�ιܵμ�����ˮ����Һ����̶������У�
�۽���Һת�Ƶ�����ƿ�У�
�ܸǺ�ƿ�����������µߵ���ҡ�ȣ�
������������ˮϴ���ձ��ڱںͲ�����2��3�Σ�ϴ��Һת�Ƶ�����ƿ�С�
��4�����ʵ�������ȱ�ٲ���ݣ������������Һ�����ʵ���Ũ��__________ ���ƫ�ߡ���ƫ�͡�����Ӱ�족����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������������ȷ����
A. �������ۼ�����Ϊ0.4NA�İ���(P4)�ͼ�������ʵ������
B. 1 mol Na��O2��Ӧ������Na2O��Na2O2�Ļ���ﹲʧȥNA������
C. 1mol Na2O2�����к�����������Ϊ4NA
D. 25��ʱ��pH=13������������Һ��Լ����NA������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ����
A.H2SO4�ữ��KI��Һ�м���H2O2��2I-+H2O2+2H+=I2+2H2O
B.SO2ͨ��BaCl2��Һ�У�SO2+Ba2++H2O=BaSO3��+2H+
C.(NH4)2Fe(SO4)2��Һ�м�������NaOH��Һ��NH4++OH-=NH3��H2O
D.��CuCl2��Һ��������ʵ�飬���ݷ��⣺CuCl2![]() Cu2++2Cl-
Cu2++2Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I. ����12�����ʣ���A1 ��ϡ���� ��H2SO4 ��Һ�� ��CO2 ���� ��NaCl CaCO3 NaHCO3 �ƾ�![]() Al2O3
Al2O3 ![]() ʯī���������������ڵ���ʵ�����״̬�²����������____________������ţ���ͬ��,���ڷǵ���ʵ���___________��
ʯī���������������ڵ���ʵ�����״̬�²����������____________������ţ���ͬ��,���ڷǵ���ʵ���___________��
II.��Ҫ����д��ѧ���
(1)Na2SO4�ĵ��뷽��ʽ��_______________________��
(2)Ba(OH)2��CuSO4��ϡ��Һ��ϵ����ӷ���ʽ��______________________��
(3)дһ������Fe3++30H-�TFe(OH)3��ʾ�Ļ�ѧ����ʽ��______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA�ǰ����ӵ�������ֵ������˵������ȷ����
A.16.25 g FeCl3ˮ���γɵ�Fe(OH)3����������С��0.1 NA
B.22.4 L����״����������е�������Ϊ18NA
C.���³�ѹ�£�124 g P4������P��P����ĿΪ6NA
D.0.1 mol H2��0.1 mol I2���ܱ������г�ַ�Ӧ�����������С��0.2 NA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com