
【题目】利用微生物燃料电池进行废水处理,实现碳氮联合转化。其工作原理如下图所示,其中M、N为厌氧微生物电极。
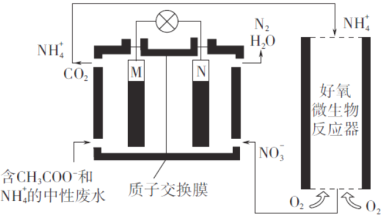
下列有关叙述错误的是
A. 负极的电极反应为CH3COO-—8e-+2H2O==2CO2↑+7H+
B. 电池工作时,H+由M极移向N极
C. 相同条件下,M、N两极生成的CO2和N2的体积之比为3:2
D. 好氧微生物反应器中发生的反应为NH3+2O2==NO3-+2H++H2O
【答案】C
【解析】
图示分析可知:N极NO3-离子得到电子生成氮气、发生还原反应,则N极正极。M极CH3COO-失电子、发生氧化反应生成二氧化碳气体,则M极为原电池负极,NH4+在好氧微生物反应器中转化为NO3-,据此分析解答。
A.M极为负极,CH3COO-失电子、发生氧化反应生成二氧化碳气体,电极反应为CH3COO-—8e-+2H2O==2CO2↑+7H+,故A正确;B.原电池工作时,阳离子向正极移动,即H+由M极移向N极,故B正确;C.生成1molCO2转移4mole-,生成1molN2转移10mol e-,根据电子守恒,M、N两极生成的CO2和N2的物质的量之比为10mol:4mol=5:2,相同条件下的体积比为5:2,故C错误;D.NH4+在好氧微生物反应器中转化为NO3-,则反应器中发生的反应为NH3+2O2==NO3-+2H++H2O,故D正确;故答案为C。


科目:高中化学 来源: 题型:
【题目】观察下面四幅图,下图叙述正确的说法有

①甲中共有5种核苷酸
②组成人体每种蛋白质的化合物乙都约为20种
③组成丙化合物的单糖是脱氧核糖
④松鼠体细胞内检测到的化合物丁很可能是蔗糖
A. 1种 B. 2种 C. 3种 D. 4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X(5没食子酰基奎宁酸)具有抗氧化性和抗利什曼虫活性而备受关注,X的结构简式如图所示。下列有关X的说法正确的是 ( )

A. 分子式为C14H15O10
B. 分子中有四个手性碳原子
C. 1 mol X最多可与4 mol NaOH反应
D. 1 mol X最多可与4 mol NaHCO3反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知下列热化学方程式:
H2(g)+1/2O2(g)==H2O(l) ΔH=285.8 kJ·mol1
H2(g)+1/2O2(g)==H2O(g) ΔH=241.8 kJ·mol1
C(s)+ 1/2O2(g)==CO(g) ΔH=110.5 kJ·mol1
C(s)+O2(g)==CO2(g) ΔH=393.5 kJ·mol1
回答下列问题:
①燃烧10gH2生成液态水,放出的热量为________。
②CO的燃烧热为________。
(2)0.3mol乙硼烷气体(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ的热量,则其热化学方程式为________________________。
(3)已知稀溶液中,1molH2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出稀H2SO4溶液与稀NaOH溶液反应的热化学方程式__________________。
(4)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol–1
2SO3(g) ΔH=-196.6 kJ·mol–1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol–1
2NO2(g) ΔH=-113.0 kJ·mol–1
请写出NO2与SO2反应生成SO3和NO的热化学方程式____________________。
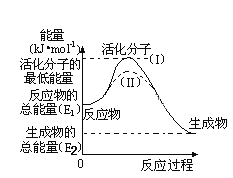
(5)研究活化能对于能源技术的革新有非常重大的实际意义。请认真观察下图,回答问题:
①图中反应的ΔH=_____________kJ/mol(用含有E1、E2代数式表示)。
②已知热化学方程式:H2(g)+1/2O2(g) = H2O(g) ΔH=-241.8kJ/mol,该反应的活化能为167.2kJ/mol,则H2O(g)=H2(g)+1/2O2(g)的活化能为________kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素周期表的说法正确的是( )
A.Li是最活泼金属,F是最活泼非金属
B.1H2、2H2、3H2互称同位素
C.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行
D.同一周期(第一周期除外)的元素,从左到右由金属逐渐过渡到非金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,ΔH1=393.5 kJ·mol1,ΔH2=395.4 kJ·mol1,下列有关说法或表示式正确的是( )

A. C(s,石墨) = C(s,金刚石) ΔH=1.9 kJ·mol1
B. 石墨和金刚石的转化是物理变化
C. 金刚石的稳定性比石墨的弱
D. 1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y是合成香料、医药、农药及染料的重要中间体,可由X在一定条件下合成:

下列说法不正确的是
A. Y的分子式为C10H8O3
B. 由X制取Y的过程中可得到乙醇
C. 一定条件下,Y能发生加聚反应和缩聚反应
D. 等物质的量的X、Y分别与NaOH溶液反应,最多消耗NaOH的物质的量之比为3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.氯气是一种重要的工业原料。工业上利用反应3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。
(1)该反应中氧化剂是____________ ,氧化产物是____________。用单线桥表示反应的电子转移__________________。
(2)从反应可以看出氧化性:Cl2___________N2(填“>” “<”“=” )。若71g氯气参与反应,理论上生成N2的体积(标准状况)为_________________L(保留小数点后一位)。工作人员通过能否看到白烟判断管道是否漏气,请结合上述反应,写出生成的白烟的化学式______________。
Ⅱ.实验室现需配制100 mL 0.1mol/L的氢氧化钠溶液,请将步骤补充完整
计算可得需要氢氧化钠的质量为_____________ g。
将称量好的固体放入小烧杯中,加适量蒸馏水溶解;
将所得溶液冷却至室温后,沿玻璃棒小心转入100 mL_________(填仪器名称)
用少量蒸馏水烧杯2~3次,每次洗涤液都转入容量瓶中;
继续加蒸馏水至液面距刻度线1~2cm处,改用____________小心滴加蒸馏水至刻度线处;摇匀;装瓶,贴标签。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如下:

(1)上述工艺中采用气液逆流接触吸收(尾气从吸收塔底部进入,石灰乳从吸收塔顶部喷淋),其目的是______________________________;滤渣可循环利用,滤渣的主要成分是____________(填化学式)。
(2)该工艺需控制NO和NO2物质的量之比接近1∶1。
若排放的尾气中NO含量升高,则NO和NO2物质的量之比______;若产品Ca(NO2)2中Ca(NO3)3含量升高,则NO和NO2物质的量之比_______。(填写序号)
①=1∶1 ②>1∶1 ③<1∶1 ④无法判断
(3)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,据此信息,某同学所写的反应离子方程式为2NO2-+2H+=NO2+NO↑+H2O,你同意吗?_________(填“同意”或“不同意“),如不同意,请说明你的理由________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com