
����Ŀ��NO��CO���������ŷ�β���е��к����ʣ���Ҫ��һ�����������á�
(1)��֪��CO�ɽ����ֵ��������ﻹԭΪN2��
��Ӧ��2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ��H = ��746 kJ��mol��1
N2(g)+2CO2(g) ��H = ��746 kJ��mol��1
��Ӧ��4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) ��H = ��1200 kJ��mol��1
N2(g)+4CO2(g) ��H = ��1200 kJ��mol��1
д��CO��NO2��ԭΪNO���Ȼ�ѧ����ʽ__________________��
(2)���ܱ������г���5 mol CO��4 mol NO������������ӦI����ͼΪƽ��ʱNO������������¶ȡ�ѹǿ�Ĺ�ϵ��

�ش��������⣺
���¶ȣ�T1_________T2(����������������)��
��ij�¶��£������Ϊ2 L���ܱ������У���Ӧ����10���ӷų�����373 kJ����CO��Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(CO)=_____________��ͼ��A~G���У�����Ӧ����������______��(�����)
��ij�¶��£���Ӧ�ﵽƽ��״̬D��ʱ���������Ϊ2 L����ʱ��ƽ�ⳣ��K =_____(�����ȷ��0.01)��
(3)��ҵ�Ͽ�������CO��H2��Ӧ�ϳɼ״���CO(g)+2H2(g)![]() CH3OH(g) ��H�������¶Ⱥ��ݻ���ͬ�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ���÷�Ӧ�ﵽƽ��ʱ���й��������±���
CH3OH(g) ��H�������¶Ⱥ��ݻ���ͬ�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ���÷�Ӧ�ﵽƽ��ʱ���й��������±���
���� | ��Ӧ��Ͷ���� | ��Ӧ���ת���� | CH3OH��Ũ��(mol/L) | �����仯(Q1��Q2��Q3������0) |
1 | 1molCO��2molH2 | a1% | c1 | �ų�Q1KJ���� |
2 | 1molCH3OH | a2% | c2 | ����Q2KJ���� |
3 | 2molCO��4molH2 | a3% | c3 | �ų�Q3KJ���� |
�ٸ÷�Ӧ����HΪ_________��(�ô�Q1��Q2��Q3��ʽ�ӱ�ʾ)
�����й�ϵһ����ȷ������______��
A. c1= c2 B. a1 >a3 C.a1=a2 D. 2Q1 < Q3
���𰸡�CO(g)+NO2(g)==CO2(g)+NO(g) H=-227 kJ/mol > 0.05 molL-1min-1 C 0.22 Lmol-1 -(Q1+Q2) AD
��������
(1)��Ӧ����2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ��H = ��746 kJ��mol��1
N2(g)+2CO2(g) ��H = ��746 kJ��mol��1
��Ӧ����4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) ��H = ��1200 kJ��mol��1
N2(g)+4CO2(g) ��H = ��1200 kJ��mol��1
��(��Ӧ��-��Ӧ��)��2������CO��NO2��ԭΪNO���Ȼ�ѧ����ʽ��
(2)������ӦΪ���ȷ�Ӧ������ͬѹǿ�£������¶ȣ�ƽ�������ƶ�������NO�������������ȷ��T1��T2�Ĺ�ϵ��
��373 kJΪ746��һ�룬��μӷ�Ӧ��COΪ1mol����CO��Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(CO)=![]() ��ͼ��A~G���У����¶Ⱥ�ѹǿ��������ȷ������Ӧ�������ĵ㡣
��ͼ��A~G���У����¶Ⱥ�ѹǿ��������ȷ������Ӧ�������ĵ㡣
��ij�¶��£���Ӧ�ﵽƽ��״̬D��ʱ���������Ϊ2 L����������ʽ�����ƽ��ʱ��Ӧ�����������Ũ�ȣ��Ӷ����ƽ�ⳣ��K��
(3)������1������Ӧ��ʼ������2���淴Ӧ��ʼ��ƽ��ʱ���ߵ�Ч���ɴ˿�ȷ���÷�Ӧ�ġ�H��
�ڽ�ϵ�Чƽ��˼����з�����
(1)��Ӧ����2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ��H = ��746 kJ��mol��1
N2(g)+2CO2(g) ��H = ��746 kJ��mol��1
��Ӧ����4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) ��H = ��1200 kJ��mol��1
N2(g)+4CO2(g) ��H = ��1200 kJ��mol��1
��(��Ӧ��-��Ӧ��)��2������CO��NO2��ԭΪNO���Ȼ�ѧ����ʽΪCO(g)+NO2(g)==CO2(g)
+NO(g) H=-227 kJ/mol������CO(g)+NO2(g)==CO2(g)+NO(g) H=-227 kJ/mol��
(2)������ӦΪ���ȷ�Ӧ������ͬѹǿ�£������¶ȣ�ƽ�������ƶ���T1ʱ��NO����������Ӷ�ȷ��T1>T2����Ϊ��>��
��373 kJΪ746��һ�룬��μӷ�Ӧ��COΪ1mol����CO��Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(CO)=![]() = 0.05 molL-1min-1����ǰ�������T1���¶ȸߣ���C��ѹǿ����¶��ָߣ���������Ӧ�������ĵ�ΪC�㡣��Ϊ��0.05 molL-1min-1��C��
= 0.05 molL-1min-1����ǰ�������T1���¶ȸߣ���C��ѹǿ����¶��ָߣ���������Ӧ�������ĵ�ΪC�㡣��Ϊ��0.05 molL-1min-1��C��
����CO�ı仯��Ϊ2x��������ʽΪ��
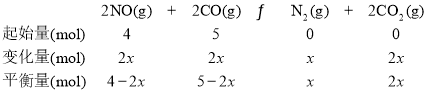
![]() ��x=1mol��K=
��x=1mol��K=![]() =0.22������0.22��
=0.22������0.22��
(3)������1������Ӧ��ʼ������2���淴Ӧ��ʼ��ƽ��ʱ���ߵ�Ч���ɴ˿�ȷ���÷�Ӧ�ġ�H= -(Q1+Q2)KJ/mol����Ϊ��-(Q1+Q2) KJ/mol��
��A. ����1������2��ƽ��Ϊ��Чƽ�⣬��c1= c2��A��ȷ��
B.����3�൱������1ѹ���������Ϊԭ���Ķ���֮һ����ƽ�������ƶ���a1 <a3��B����
C. ����1������2��ƽ��Ϊ��Чƽ�⣬��Ӧ���ת���ʲ�һ��Ϊ50%������a1��a2��һ����ȣ�C����
D. ����3�൱������1ѹ���������Ϊԭ���Ķ���֮һ����ƽ�ⲻ�ƶ�����


 ��һ����ͬ���ɽ�����ϵ�д�
��һ����ͬ���ɽ�����ϵ�д� ������Ӧ���ϵ�д�
������Ӧ���ϵ�д� ��ʦ�㾦�ִʾ��ƪϵ�д�
��ʦ�㾦�ִʾ��ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������̼�IJ����������������ҹ���Դ�����һ����Ҫս�Է���չ��һ����Ҫ�����˲�ҵ��
��1����֪��CH4��CO��H2��ȼ���ȷֱ�Ϊ890kJ��mol-1��283kJ��mol-1��285.5kJ��mol-1���������з�Ӧ�ķ�Ӧ�ȣ�CO2(g)+CH4(g)=2CO(g)+2H2(g) ��H��___kJ��mol-1��
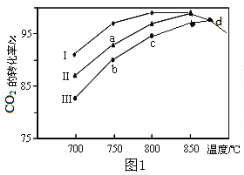
��2�����÷����е�CO2Ϊԭ����ȡ�״�����Ӧ����ʽΪ��CO2+3H2![]() CH3OH+H2O����������ͬ���ü״��ϳɷ�Ӧ�ڲ�ͬ������I��II��III�������·�Ӧ��ͬʱ���CO2��ת�����淴Ӧ�¶ȵı仯��ͼ1��ʾ��
CH3OH+H2O����������ͬ���ü״��ϳɷ�Ӧ�ڲ�ͬ������I��II��III�������·�Ӧ��ͬʱ���CO2��ת�����淴Ӧ�¶ȵı仯��ͼ1��ʾ��
�ٸ÷�Ӧ�ġ�H__0����������������������
��d�㲻ͬ������I��II��III��������CO2��ת������ͬ��ԭ����___��
��3���ö�����̼���������ϳɵ�̼ϩ������ʼʱ��0.1MPa��n(H2)��n(CO2)=3��1��Ͷ�ϱȳ��뷴Ӧ���У�������Ӧ��2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ��H����ͬ�¶���ƽ��ʱ��������̬���ʵ����ʵ�����ͼ2��ʾ��
C2H4(g)+4H2O(g) ��H����ͬ�¶���ƽ��ʱ��������̬���ʵ����ʵ�����ͼ2��ʾ��
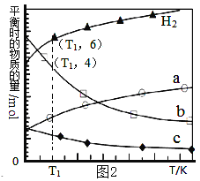
�ٸ÷�Ӧ��___�Է����У�������������������������
��b������������___��
��T1�¶��µ�ƽ��ת����Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��������������۲���ȷ��( )
ѡ�� | ʵ�鲽�� | ���� | ���� |
A | �����Ը��������Һ�еμӲ�����Һ | ��Һ��ɫ | ������л�ԭ�� |
B | ��Na2CrO4��Һ�еμӹ���Ũ���� | ��Һ�ɻ�ɫת��Ϊ�Ȼ�ɫ | CrO42-��������������ȫתΪCr2O72- |
C | װ��NO2����ƿ������ˮ�� | ��ƿ����ɫ���� | �����¶ȣ�ƽ��2NO2 |
D | ��Na2S2O3��Һ�еμ�ϡ���� | �е���ɫ�������� | S2O32-��H+���ܹ��� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(����)
A.ij����������Ϊ2��2��4��4-�ļ�-3��3��5-���һ�����
B.�������ļ�ȩ������[CH3CH(OH)COOH]��ȫȼ�������������������
C.��ͼ��ij�л�����ӵı���ģ�ͣ������ʿ�����һ�ְ�����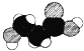
D.������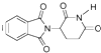 ������������ˮ�⣬������Һ�Ӽ�������NH3����
������������ˮ�⣬������Һ�Ӽ�������NH3����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧΪ��̽������CO2�ķ�Ӧ��������ͼװ�ý���ʵ�顣����֪PdCl2�ܱ�CO��ԭΪ��ɫ��Pd��

��1��װ�â�����ϡ������CaCO3��Ӧ�Ʊ�CO2���ڼ�ϡ����ʱ������CaCO3��ϡ����ܽӴ�����ϡ�����ֲ����ˣ�Ϊʹ��Ӧ��˳�����У�����©���м�����Լ���_______��
A. H2SO4��Һ B. CCl4 C. �� D. ϡ����
��2���뽫ͼ�и�װ�ð�˳�����ӣ���װ�ýӿ���ĸ����c��______��______��____��____��______��____��____��
��3��װ�âܵ�������__________��
��4�������װ�������Բ�װ��ҩƷ��ȼ�ƾ���֮ǰӦ���еIJ����Ǵ��ɼУ���CO2��������װ�ã����۲쵽_________ʱ�ٵ�ȼ�ƾ��ơ�
��5������Ӧ������CO2����������CO2��ַ�Ӧ�����ɵĹ������ʿ����ж����������ͬѧ������²��룺
�����ɵĹ�������ΪNa2CO3
�����ɵĹ�������ΪNs2CO3��C�Ļ����
�����ɵĹ�������ΪNs2CO3��Na2O�Ļ����
�����ɵĹ�������ΪNs2O��C�Ļ����
���練Ӧ���������������������
I. �۲쵽װ�â�PdCl2��Һ���к�ɫ��������װ�â��й���ɷ�ֻ��һ�֣���������м���ϡ����ɲ�����ʹ����ʯ��ˮ����ǵ����壬д�������������CO2��Ӧ�Ļ�ѧ����ʽ____��
II. װ�â����Ƶ�����Ϊ0.46g����ַ�Ӧ��װ�â��еĹ������������ϡ�����в���224ml����״����CO2���壬��Һ�в������������Ϊ___________��
��6�����ʵ�鷽��֤��װ�â��м���Ľ����Ʋ��ֱ�����____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ӦX(g)+3Y(g)![]() 2Z(g) ��H�������仯����ͼ��ʾ������˵����ȷ����
2Z(g) ��H�������仯����ͼ��ʾ������˵����ȷ����

A. ��H= E2- E1 B. ����������,E3����
C. ��ѹ�³���һ�����ĺ���n(Z)���� D. ѹ��������c(X)��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���F(C21H20O6)���ٴ�ҽѧ�Ͼ���Ԥ�����������ã���ϳ�·�����£����з�Ӧ���з�Ӧ���ԭ��������Ϊ100����
��֪����. ![]()
![]()
![]() +H2O
+H2O
��. ![]()
![]()
![]() +CO2
+CO2
��. ![]() +
+![]()
![]()
![]() +H2O
+H2O
��ش��������⣺
(1) B�к��еĹ�����������____________��
(2)��Ӧ�ٵĻ�ѧ����ʽ��____________�� ��Ӧ�ܵĻ�ѧ����ʽ��____________��
(3) F�Ľṹ��ʽ��____________��
(4) E��ͬ���칹���У�ͬʱ�����������������Ĺ���__________�֣����к˴Ź�����������4�����շ��ͬ���칹��Ľṹ��ʽΪ__________��
�ٱ����ϵ�һȡ����ֻ��2�֣�
��1mol������������NaOH��Һ��Ӧʱ����Ӧ����3molNaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���100 mL 0.01 molL��1 HA��Һ����μ���0.02 molL��1��MOH��Һ��ͼ����ʾ���߱�ʾ�����Һ��pH�仯���������˵������ȷ����
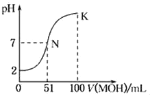
A. HAΪһԪǿ�ᣬMOHΪһԪ����
B. N����Һ������Ũ�ȴ�С��ϵΪ��c��M+��=c��A������c��H+��=c��OH����
C. N��ˮ�ĵ���̶ȴ���K��ˮ�ĵ���̶�
D. N��K֮������������һ�㶼��c��M+�� ��c��OH������c��A������c��H+��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���Ϊ��������Դ��Խ��Խ�ܵ����ǵĹ�ע����֪�״��Ʊ����йػ�ѧ��Ӧ��ƽ�ⳣ�����ʱ���������
��ѧ��Ӧ | 500��ƽ�ⳣ�� | �ʱ� |
��CO(g)��2H2(g) | K1��2.5 | ��H1����116 kJ��mol��1 |
��CO2(g)��H2(g) | K2��1.0 | ��H2����41 kJ��mol��1 |
��CO2(g)��3H2(g) | K3���� | ��H3���� |
��1����Ӧ�۵�K3��__����H3��___��
��2�����ڷ�Ӧ�������¶�ƽ�ⳣ��___(�������С�����䡱)��
��3��500��ʱ��÷�Ӧ����ijʱ��CO2(g)��H2(g)��CH3OH(g)��H2O(g)��Ũ��(mol��L��1)�ֱ�Ϊ0.1��0.8��0.3��0.15�����ʱv��__v��(����>����<������)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com