
【题目】甲醇作为可再生能源,越来越受到人们的关注。已知甲醇制备的有关化学反应的平衡常数及焓变数据如下
化学反应 | 500℃平衡常数 | 焓变 |
①CO(g)+2H2(g) | K1=2.5 | ΔH1=-116 kJ·mol-1 |
②CO2(g)+H2(g) | K2=1.0 | ΔH2=+41 kJ·mol-1 |
③CO2(g)+3H2(g) | K3=? | ΔH3=? |
(1)反应③的K3=__,ΔH3=___。
(2)对于反应②升高温度平衡常数___(填“增大”“减小”或“不变”)。
(3)500℃时测得反应③在某时刻CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.1、0.8、0.3、0.15,则此时v正__v逆(填“>”“<”或“=”)。
【答案】2.5 -75kJ·mol-1 增大 >
【解析】
(1)![]() ,据此计算;根据盖斯定律计算焓变;
,据此计算;根据盖斯定律计算焓变;
(2)吸热反应升温平衡右移;
(3)根据浓度商和平衡常数的大小关系判断;
(1)由![]() ,
,![]() ,
,![]() 可知
可知![]() =2.5×1.0=2.5;由①CO(g)+2H2(g)
=2.5×1.0=2.5;由①CO(g)+2H2(g)![]() CH3OH(g) ΔH1=-116 kJ·mol-1;②CO2(g)+H2(g)
CH3OH(g) ΔH1=-116 kJ·mol-1;②CO2(g)+H2(g)![]() H2O(g)+CO(g) ΔH2=+41 kJ·mol-1;可知③=①+②,所以ΔH3=ΔH1+ΔH2=-116 kJ·mol-1+(+41 kJ·mol-1)=-75kJ·mol-1;故答案为:2.5;-75kJ·mol-1;
H2O(g)+CO(g) ΔH2=+41 kJ·mol-1;可知③=①+②,所以ΔH3=ΔH1+ΔH2=-116 kJ·mol-1+(+41 kJ·mol-1)=-75kJ·mol-1;故答案为:2.5;-75kJ·mol-1;
(2)反应②ΔH2大于零,故为吸热反应,升高温度,平衡右移,平衡常数增大,故答案为:增大;
(3)![]() <K3,故平衡右移,则v正>v逆;故答案为:>;
<K3,故平衡右移,则v正>v逆;故答案为:>;


 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】NO和CO都是汽车排放尾气中的有害物质,需要进一步处理和利用。
(1)已知:CO可将部分氮的氧化物还原为N2。
反应Ⅰ:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H = -746 kJ·mol-1
N2(g)+2CO2(g) △H = -746 kJ·mol-1
反应Ⅱ:4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) △H = -1200 kJ·mol-1
N2(g)+4CO2(g) △H = -1200 kJ·mol-1
写出CO将NO2还原为NO的热化学方程式__________________。
(2)在密闭容器中充入5 mol CO和4 mol NO,发生上述反应I,如图为平衡时NO的体积分数与温度、压强的关系。

回答下列问题:
①温度:T1_________T2(填“<”或“>”)。
②某温度下,在体积为2 L的密闭容器中,反应进行10分钟放出热量373 kJ,用CO的浓度变化表示的平均反应速率v(CO)=_____________。图中A~G点中,正反应速率最快的是______点(填序号)
③某温度下,反应达到平衡状态D点时,容器体积为2 L,此时的平衡常数K =_____(结果精确到0.01);
(3)工业上可以利用CO与H2反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) △H。若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
CH3OH(g) △H。若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
容器 | 反应物投入量 | 反应物的转化率 | CH3OH的浓度(mol/L) | 能量变化(Q1、Q2、Q3均大于0) |
1 | 1molCO和2molH2 | a1% | c1 | 放出Q1KJ热量 |
2 | 1molCH3OH | a2% | c2 | 吸收Q2KJ热量 |
3 | 2molCO和4molH2 | a3% | c3 | 放出Q3KJ热量 |
①该反应的△H为_________;(用带Q1、Q2或Q3的式子表示)
②下列关系一定正确的是(______)
A. c1= c2 B. a1 >a3 C.a1=a2 D. 2Q1 < Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨对化学工业和国防工业具有重要意义。
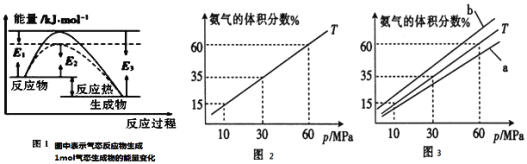
(1)根据图1请写出合成氨的热化学方程式______![]() 热量用
热量用![]() 、
、![]() 或
或![]() 表示
表示![]() 。
。
(2)向合成塔中按物质的量之比l:4充入![]() 、
、![]() 进行氨的合成,图2为
进行氨的合成,图2为![]() 时平衡混合物中氨气的体积分数与压强
时平衡混合物中氨气的体积分数与压强![]() 的关系图。
的关系图。
①图2中氨气的体积分数为![]() 时,
时,![]() 的转化率为______。
的转化率为______。
②图3中![]() ,则温度为
,则温度为![]() 时对应的曲线是______
时对应的曲线是______![]() 填“a”或“b”
填“a”或“b”![]() 。
。
(3)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为![]() ,一定温度下,在体积为2L的恒容容器中发生上述反应,各物质的物质的量变化如表:
,一定温度下,在体积为2L的恒容容器中发生上述反应,各物质的物质的量变化如表:
时间 |
|
|
|
|
0 |
|
| 0 | 0 |
5 |
|
|
|
|
7 |
|
|
|
|
10 |
|
|
|
|
①分析表中数据,判断5min时反应是否处于平衡状态?______![]() 填“是”或“否”
填“是”或“否”![]() ,前5min反应的平均反应速率
,前5min反应的平均反应速率![]() ______。
______。
②在相同实验条件下,若改为加入![]() ,若要求平衡后
,若要求平衡后![]() 在反应混合气中质量分数不变,则还需加入的物质及其物质的量为______。
在反应混合气中质量分数不变,则还需加入的物质及其物质的量为______。
③反应在![]() 内,CO的物质的量减少的原因可能是______
内,CO的物质的量减少的原因可能是______![]() 填字母
填字母![]() 。
。
![]() 减少
减少![]() 的物质的量
的物质的量 ![]() 降低温度
降低温度 ![]() 升高温度
升高温度 ![]() 充入
充入![]()
④下列方法中可以证明上述已达平衡状态的是______。
![]() 单位时间内生成
单位时间内生成![]() 的同时生成
的同时生成![]()
b.容器内压强不再变化
![]() 混合气体密度不再变化
混合气体密度不再变化
![]() 混合气体的平均相对分子质量不再变化
混合气体的平均相对分子质量不再变化
![]() 的质量分数不再变化
的质量分数不再变化
⑤已知碳的气化反应在不同温度下平衡常数的对数值![]() 如表:
如表:
气化反应式 | lgK | ||
700K | 900K | 1200K | |
|
|
|
|
|
|
|
|
则反应![]() 在900K时,该反应平衡常数的对数值
在900K时,该反应平衡常数的对数值![]() ______。
______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg与Br2反应可生成具有强吸水性的MgBr2,该反应剧烈且放出大量热。实验室采用如图装置制备无水MgBr2。已知MgBr2+3C2H5OC2H5![]() MgBr23C2H5OC2H5,MgBr23C2H5OC2H5溶于乙醚。下列说法不正确的是( )
MgBr23C2H5OC2H5,MgBr23C2H5OC2H5溶于乙醚。下列说法不正确的是( )
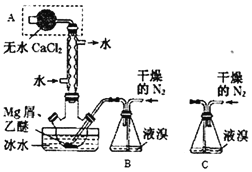
A.仪器A为干燥管,其主要作用是防止水蒸气进入反应装置
B.冷凝管的作用是导气兼起冷凝回流
C.装置B必须用干燥的N2而不能改用空气,但装置B可换成装置C
D.乙醚的作用是与MgBr2反应生成MgBr23C2H5OC2H5,并将其溶解而与Mg分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸是一种香料,具有很好的保香作用,通常作为配香原料,可使主香料的香气更加清香.实验室制备肉桂酸的化学方程式为:
 (CH3CO)2
(CH3CO)2 CH3COOH
CH3COOH
主要试剂及其物理性质
名称 | 分子量 | 性状 | 密度 | 熔点 | 沸点 | 溶解度:克 | ||
水 | 醇 | 醚 | ||||||
苯甲醛 | 106 | 无色液体 |
|
|
|
| 互溶 | 互溶 |
乙酸酐 | 102 | 无色液体 |
|
|
| 12 | 溶 | 不溶 |
肉桂酸 | 148 | 无色结晶 |
|
| 300 |
| 24 | 溶 |
密度:常压,![]() 测定主要实验步骤和装置如下:
测定主要实验步骤和装置如下:
Ⅰ![]() 合成:按图1连接仪器,加入
合成:按图1连接仪器,加入![]() 苯甲醛、
苯甲醛、![]() 乙酸酐和
乙酸酐和![]() 无水碳酸钾.在
无水碳酸钾.在![]() ,将此混合物回流45min.
,将此混合物回流45min.
Ⅱ![]() 分离与提纯:
分离与提纯:![]() 将上述合成的产品冷却后边搅拌边加入40ml水浸泡5分钟,并用水蒸气蒸馏,从混合物中除去未反应的苯甲醛,得到粗产品;
将上述合成的产品冷却后边搅拌边加入40ml水浸泡5分钟,并用水蒸气蒸馏,从混合物中除去未反应的苯甲醛,得到粗产品;![]() 将上述粗产品冷却后加入40ml
将上述粗产品冷却后加入40ml![]() 的氢氧化钠水溶液,再加90ml水,加热活性炭脱色,趁热过滤、冷却;
的氢氧化钠水溶液,再加90ml水,加热活性炭脱色,趁热过滤、冷却;![]() 将1:1的盐酸在搅拌下加入到肉桂酸盐溶液中,至溶液呈酸性,经冷却、减压过滤、洗涤、干燥等操作得到较纯净的肉桂酸;
将1:1的盐酸在搅拌下加入到肉桂酸盐溶液中,至溶液呈酸性,经冷却、减压过滤、洗涤、干燥等操作得到较纯净的肉桂酸;
水蒸气蒸馏:使有机物可在较低的温度下从混合物中蒸馏出来,可以避免在常压下蒸馏时所造成的损失,提高分离提纯的效率.同时在操作和装置方面也较减压蒸馏简便一些,所以水蒸气蒸馏可以应用于分离和提纯有机物.回答下列问题:
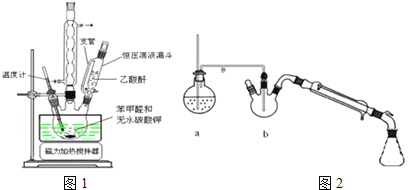
(1)合成肉桂酸的实验需在无水条件下进行,实验前仪器必须干燥的原因是 ______ ![]() 实验中为控制温度在
实验中为控制温度在![]() 需在 ______ 中加热.
需在 ______ 中加热.
A.水![]() 甘油
甘油![]() 沸点
沸点![]()
![]() 砂子
砂子![]() 植物油
植物油![]() 沸点
沸点![]()
(2)图2中装置a的作用是 ______ ,装置b中长玻璃导管要伸入混合物中的原因是 ______ ,水蒸气蒸馏后产品在 ______ ![]() 填仪器名称
填仪器名称![]() ;
;
(3)趁热过滤的目的 ______ ;
(4)加入1:1的盐酸的目的是 ______ ,析出肉桂酸晶体过滤后洗涤,洗涤剂是 ______ ;
(5)5.3g苯甲醛、![]() 乙酸酐和
乙酸酐和![]() 无水碳酸钾充分反应得到肉桂酸实际
无水碳酸钾充分反应得到肉桂酸实际![]() ,则产率是 ______
,则产率是 ______ ![]() 保留3位有效数字
保留3位有效数字![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锌工业品广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,随着工业的飞速发展,我国对氧化锌的需求量日益增加,成为国民经济建设中不可缺少的重要基础化工原料和新型材料。用工业含锌废渣(主要成分为ZnO,还含有铁、铝、铜的氧化物,Mn2+、Pb2+、Cd2+等)制取氧化锌的工艺流程如图所示:

已知:相关金属离子c(Mn+)=0.1mol/L生成氢氧化物沉淀的pH如下表所示:
Fe3+ | Fe2+ | Al3+ | Mn2+ | Zn2+ | Cu2+ | Cd2+ | |
开始沉淀 | 1.5 | 6.3 | 3.4 | 8.1 | 6.2 | 6.0 | 7.4 |
沉淀完全 | 2.8 | 8.3 | 4.7 | 10.1 | 8.2 | 8.0 | 9.4 |
回答下列问题:
(1)为保证锌渣酸浸的充分,先保持酸过量,且c(H+)=0.5mol/L左右。写出一种加快锌渣浸出的方法:_______________
(2)为调节溶液的pH,则试剂X为__________________(填化学式),且调节溶液pH的范围是____________
(3)除杂时加入高锰酸钾的作用是_______________,发生反应的离子方程式为_____________
(4)“过滤”所得滤渣的主要成分是_____________________(填化学式)
(5)写出“碳化合成”的化学方程式:_____________________;“碳化合成”过程需纯碱稍过量,请设计实验方案证明纯碱过量:_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法错误的是
A.标准状况下,22.4 L环丙烷和丙烯的混合气体中所含共用电子对数为9NA
B.56g铁在足量氧气中完全燃烧,转移的电子数小于3NA
C.16g O2和14C2H4的混合物中所含中子数为8NA
D.常温下,1 L 0.5 mol/L CH3COONH4溶液的pH=7,则溶液中CH3COO-与NH4+的数目均为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳九”是在石油提炼时获得的一系列含碳数量在9左右的烃,沸点处于汽油和柴油之间。“碳九”有两种,分为裂解碳九和重整碳九,前者主要为烷烃.烯烃等链烃,后者主要为丙苯、对甲乙米等芳香烃。下列有关说法错误的是
A.若将“碳九"添加到汽油中,可能会使汽油燃烧不充分而形成积炭
B.用溴水可以区分裂解碳九和重整碳九
C.均三甲苯( )的二氯代物有5种
)的二氯代物有5种
D.异丙苯[![]() ]和对甲乙苯(
]和对甲乙苯(![]() )互为同系物
)互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向某二元弱酸H2X的钠盐溶液中滴加盐酸,混合溶液中离子浓度与pH的关系如图所示,其中lgX =lgc(X2-)/ c(HX-) 或lgc(HX-)/c(H2X)。下列叙述不正确的是

A. 当溶液呈中性时, c(HX-)>c(X2-)>c(H2X)
B. 曲线m表示lgc(X2-)/c(HX-)与pH的变化关系
C. Ka1(H2X)的数量级为10-7
D. 25℃时,NaHX溶液中:c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com