
����Ŀ����̼��������ʯ������ʱ��õ�һϵ�к�̼������9���ҵ���,�е㴦�����ͺͲ���֮�䡣��̼���������֣���Ϊ�ѽ�̼�ź�����̼��,ǰ����ҪΪ����.ϩ��������,������ҪΪ�������Լ����ȷ������������й�˵���������
A.������̼��"���ӵ�������,���ܻ�ʹ����ȼ�ղ���ֶ��γɻ�̿
B.����ˮ���������ѽ�̼�ź�����̼��
C.�����ױ��� ���Ķ��ȴ�����5��
���Ķ��ȴ�����5��
D.�����[![]() ]�ͶԼ��ұ���
]�ͶԼ��ұ���![]() ����Ϊͬϵ��
����Ϊͬϵ��
���𰸡�D
��������
A. ����̼����̼ԭ�Ӹ��������͵Ķ࣬����ȼ��ʱ������ȼ�ղ���ֲ�������̼���γ�����̼������A��ȷ��
B. �ѽ�̼���к���ϩ����������ˮ�����ӳɷ�Ӧ��ʹ����ɫ����B��ȷ��
C. �����ױ��Ķ��ȴ����У����� ��ԭ����ͬһ��̼ԭ���ϵ���1�֣�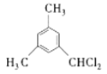 ���ڲ�̼ͬԭ���ϵ���4�֣�
���ڲ�̼ͬԭ���ϵ���4�֣�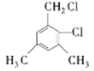 ��
�� ������5�֣���C��ȷ��
������5�֣���C��ȷ��
D. �������Լ�������ʽ��ͬ��������ͬϵ���з���������һ�������ɸ���CH2"ԭ���ŵ�Ҫ��D����
�ʴ�ΪD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���100 mL 0.01 molL��1 HA��Һ����μ���0.02 molL��1��MOH��Һ��ͼ����ʾ���߱�ʾ�����Һ��pH�仯���������˵������ȷ����
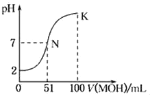
A. HAΪһԪǿ�ᣬMOHΪһԪ����
B. N����Һ������Ũ�ȴ�С��ϵΪ��c��M+��=c��A������c��H+��=c��OH����
C. N��ˮ�ĵ���̶ȴ���K��ˮ�ĵ���̶�
D. N��K֮������������һ�㶼��c��M+�� ��c��OH������c��A������c��H+��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���Ϊ��������Դ��Խ��Խ�ܵ����ǵĹ�ע����֪�״��Ʊ����йػ�ѧ��Ӧ��ƽ�ⳣ�����ʱ���������
��ѧ��Ӧ | 500��ƽ�ⳣ�� | �ʱ� |
��CO(g)��2H2(g) | K1��2.5 | ��H1����116 kJ��mol��1 |
��CO2(g)��H2(g) | K2��1.0 | ��H2����41 kJ��mol��1 |
��CO2(g)��3H2(g) | K3���� | ��H3���� |
��1����Ӧ�۵�K3��__����H3��___��
��2�����ڷ�Ӧ�������¶�ƽ�ⳣ��___(�������С�����䡱)��
��3��500��ʱ��÷�Ӧ����ijʱ��CO2(g)��H2(g)��CH3OH(g)��H2O(g)��Ũ��(mol��L��1)�ֱ�Ϊ0.1��0.8��0.3��0.15�����ʱv��__v��(����>����<������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������̫���ܵ�ؾ���ͭ������CIGS�Ȼ����ﱡĤ̫���ܵ���Լ���ĤSiϵ̫���ܵ�ء�
��1���������Siԭ�ӵ��ӻ���ʽ��___����̬Gaԭ�Ӻ�������Ų�ʽΪ___��
��2��������ͭ��Һ����εμ�Ũ��ˮ���ȳ�����ɫ��״��������������ܽ�õ�[Cu��NH3��4]SO4������ɫ����Һ��
��NH3��������ˮ������ΪNH3��H2O���Ǽ��Է����⣬����Ϊ____��
����[Cu��NH3��4]2+��Cu2+��NH3֮���γɵĻ�ѧ����Ϊ___���ṩ�µ��ӶԵijɼ�ԭ����___��
��[Cu��NH3��4]2+���жԳƵĿռ乹�ͣ�[Cu��NH3��4]2+�е�����NH3������C1-ȡ�����ܵõ����ֲ�ͬ�ṹ�IJ����[Cu��NH3��4]2+�Ŀռ乹��Ϊ___��
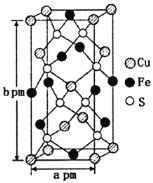
��3��ij��ͭ������ľ�����ͼ��ʾ���������µ���Ϊ�����Σ���������洹ֱ������ÿ��Cuԭ����____��Sԭ����������ͭ������Ļ�ѧʽΪ____����NAΪ�����ӵ�������ֵ����þ������ܶ�Ϊ___gcm3���ú�a��b��NA�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£��������ʵ��ܶȻ��������±���
���� | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp |
|
|
|
|
��1��ij����CuCl2��Һ�к�������FeCl3��Ϊ�Ƶô���CuCl2��Һ�����ȼ���_______�����Լ�����ʽ����Ȼ�������ҺpH��4��ʹFe3��ת��ΪFe(OH)3��������ʱ��Һ�е�c(Fe3��)��________________��
��2������CuCl��CuI���干�������Һ�У�C��Cl-��______C��I-������ > < =��
ij��Һ��C��Cl-��Ϊ0.0001 mol��L��1, C��I-��Ϊ0.1 mol��L��1������Һ�еμ�������ͭ���Ȳ����ij�����__________���������ѧʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ⶨijNaOH��Һ�����ʵ���Ũ�ȣ�����0.100 0 mol��L��1��HCl����Һ�ζ������(�ü�����ָʾ��)����ش��������⣺
��1���ζ�ʱ��ʢװ����NaOH��Һ����������Ϊ________��
��2���ζ����յ����ɫ�仯Ϊ____________��
��3������ѧ����ʵ���������������ƽ��ʵ�飬���ݼ�¼���£����ʱ���ı���Һ�����Ϊ__________�����������NaOH��Һ�����ʵ���Ũ��Ϊ______��(������λ��Ч����)
ʵ�� ��� | ����NaOH��Һ�����/mL | 0.100 0 mol��L��1 HCl��Һ�����/mL | |
�ζ�ǰ�̶� | �ζ���̶� | ||
1 | 25.00 | 0.00 | 26.29 |
2 | 25.00 | 1.00 | 31.00 |
3 | 25.00 | 1.00 | 27.31 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ������������ǣ� ��
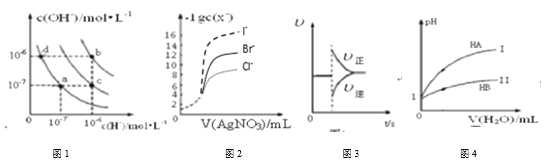
A.ͼ1����b���Ӧ�¶��£���pH��2��H2SO4��Һ��pH��12��NaOH��Һ�������Ϻ���Һ������
B.��0.0100 mol/L����������Һ���ζ�Ũ�Ⱦ�Ϊ0.1000 mol/L Cl����Br����I���Ļ����Һ����ͼ2���ߣ���ȷ�����ȳ�������Cl��
C.ͼ3��ʾ��N2(g)+3H2(g) ![]() 2NH3(g)�ﵽƽ���СNH3Ũ��ʱ���ʵı仯
2NH3(g)�ﵽƽ���СNH3Ũ��ʱ���ʵı仯
D.ͼ4��ʾ�����£�ϡ��HA��HB�������ϡ��Һʱ����ҺpH���ˮ���ı仯��������ʵ���Ũ�ȵ�NaA��NaB�����Һ�У�c(Na+)>c(A-)>c(B-)>c(OH-)>c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в������Լ�ѡ���������
A.���������ᾧ�����ȹ��˵ķ����ᴿ������![]() ���ʵ�NaCl
���ʵ�NaCl
B.ij����������ˮ�ܽ⣬ȡ�ϲ���Һ����KSCN��Һ���ֺ�ɫ��ԭ������һ����![]()
C.ij����ˮ���μ�ϡ�����������ټ�![]() ��Һ�����ְ�ɫ��������ԭˮ����һ����
��Һ�����ְ�ɫ��������ԭˮ����һ����![]()
D.��������![]() ��Һ����
��Һ����![]() ��Һ���Ƿ���
��Һ���Ƿ���![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���Ʊ�������茶���[(NH4)3Fe(C2O4)3]�Ĺ����������£�
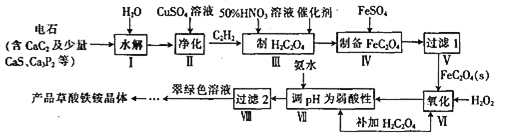
�ش��������⣺
(1)CaC2�ĵ���ʽΪ__________
(2)��������Ҫ�dz�ȥH2S��PH3���������塣�ڳ�PH3ʱ��PH3������ΪH3PO4��CuSO4����ԭΪCu���÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ____________
(3)��������H2C2O4ʱ��Ҫ��������Ļ�ԭ����ΪNO���÷�Ӧ�Ļ�ѧ����ʽΪ______________�������Ũ�ȼ���Ӧ�¶ȶ����˹��ߣ�����Ϊ____________.
(4)������1����Գ�������ϴ�Ӽ������Ƿ�ϴ�Ӹɾ���������____________________
(5)��������VII���Ӳ����Ŀ����______________________.
(6)����VIII����Һ�Ƶò�Ʒ�IJ���Ϊ____________��____________�����ˡ�ϴ�ӡ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com