
【题目】常温下,几种物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp |
|
|
|
|
(1)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净CuCl2溶液,宜先加入_______(填试剂分子式),然后调至溶液pH=4,使Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________________。
(2)在有CuCl与CuI固体共存的悬浊液中,C(Cl-)______C(I-)(填 > < =)
某溶液中C(Cl-)为0.0001 mol·L-1, C(I-)为0.1 mol·L-1,往溶液中滴加硝酸亚铜,先产生的沉淀是__________(填沉淀化学式)
【答案】CuO或Cu(OH)2或Cu2(OH)2CO3 2.6×10-9 > CuI
【解析】
根据题意可知,本题考查除杂试剂的选择和沉淀转化知识,运用除杂原理和沉淀转化原理分析。
(1)为得到纯净的CuCl2溶液,就得除去氯化铁杂质,需要加入的物质和氯化铁反应生成氢氧化铁且不能引进新的杂质,所加入物质后应能转化为氯化铜,所以应该加入含铜元素和氢氧根离子的物质,可以是CuO或Cu(OH)2或Cu2(OH)2CO3;溶液的pH=4,所以溶液中氢离子浓度为104 mol/L,则氢氧根离子浓度为1010 mol/L,根据氢氧化铁的KSP=c(Fe3+)c3(OH-)可知,c(Fe3+)= ![]() =
=![]() =2.6×10-9mol/L;
=2.6×10-9mol/L;
故答案为:CuO或Cu(OH)2或Cu2(OH)2CO3;2.6×10-9;
(2)根据图表所示,两种物质的溶度积常数可知,在有CuCl与CuI固体共存的悬浊液中,C(Cl-)>C(I-);某溶液中C(Cl-)为0.0001 mol·L-1, C(I-)为0.1 mol·L-1,往溶液中滴加硝酸亚铜,因Ksp(CuCl)>Ksp(CuI),所以先产生的沉淀是CuI。
故答案为:>;CuI。


科目:高中化学 来源: 题型:
【题目】全世界每年钢铁因锈蚀造成大量的损失。某城市拟用如图方法保护埋在酸性土壤中的钢质管道,使其免受腐蚀。关于此方法,下列说法不正确的是( )
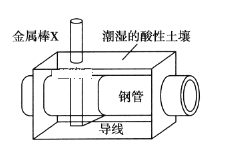
A.土壤中的钢铁易被腐蚀是因为在潮湿的土壤中形成了原电池
B.金属棒X的材料应该是比镁活泼的金属
C.金属棒X上发生反应:M-ne-=Mn+
D.这种方法称为牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸是一种香料,具有很好的保香作用,通常作为配香原料,可使主香料的香气更加清香.实验室制备肉桂酸的化学方程式为:
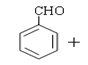 (CH3CO)2
(CH3CO)2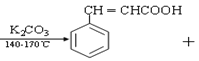 CH3COOH
CH3COOH
主要试剂及其物理性质
名称 | 分子量 | 性状 | 密度 | 熔点 | 沸点 | 溶解度:克 | ||
水 | 醇 | 醚 | ||||||
苯甲醛 | 106 | 无色液体 |
|
|
|
| 互溶 | 互溶 |
乙酸酐 | 102 | 无色液体 |
|
|
| 12 | 溶 | 不溶 |
肉桂酸 | 148 | 无色结晶 |
|
| 300 |
| 24 | 溶 |
密度:常压,![]() 测定主要实验步骤和装置如下:
测定主要实验步骤和装置如下:
Ⅰ![]() 合成:按图1连接仪器,加入
合成:按图1连接仪器,加入![]() 苯甲醛、
苯甲醛、![]() 乙酸酐和
乙酸酐和![]() 无水碳酸钾.在
无水碳酸钾.在![]() ,将此混合物回流45min.
,将此混合物回流45min.
Ⅱ![]() 分离与提纯:
分离与提纯:![]() 将上述合成的产品冷却后边搅拌边加入40ml水浸泡5分钟,并用水蒸气蒸馏,从混合物中除去未反应的苯甲醛,得到粗产品;
将上述合成的产品冷却后边搅拌边加入40ml水浸泡5分钟,并用水蒸气蒸馏,从混合物中除去未反应的苯甲醛,得到粗产品;![]() 将上述粗产品冷却后加入40ml
将上述粗产品冷却后加入40ml![]() 的氢氧化钠水溶液,再加90ml水,加热活性炭脱色,趁热过滤、冷却;
的氢氧化钠水溶液,再加90ml水,加热活性炭脱色,趁热过滤、冷却;![]() 将1:1的盐酸在搅拌下加入到肉桂酸盐溶液中,至溶液呈酸性,经冷却、减压过滤、洗涤、干燥等操作得到较纯净的肉桂酸;
将1:1的盐酸在搅拌下加入到肉桂酸盐溶液中,至溶液呈酸性,经冷却、减压过滤、洗涤、干燥等操作得到较纯净的肉桂酸;
水蒸气蒸馏:使有机物可在较低的温度下从混合物中蒸馏出来,可以避免在常压下蒸馏时所造成的损失,提高分离提纯的效率.同时在操作和装置方面也较减压蒸馏简便一些,所以水蒸气蒸馏可以应用于分离和提纯有机物.回答下列问题:
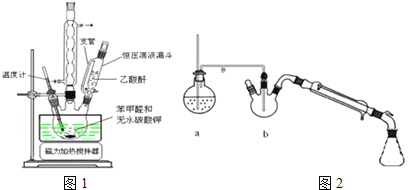
(1)合成肉桂酸的实验需在无水条件下进行,实验前仪器必须干燥的原因是 ______ ![]() 实验中为控制温度在
实验中为控制温度在![]() 需在 ______ 中加热.
需在 ______ 中加热.
A.水![]() 甘油
甘油![]() 沸点
沸点![]()
![]() 砂子
砂子![]() 植物油
植物油![]() 沸点
沸点![]()
(2)图2中装置a的作用是 ______ ,装置b中长玻璃导管要伸入混合物中的原因是 ______ ,水蒸气蒸馏后产品在 ______ ![]() 填仪器名称
填仪器名称![]() ;
;
(3)趁热过滤的目的 ______ ;
(4)加入1:1的盐酸的目的是 ______ ,析出肉桂酸晶体过滤后洗涤,洗涤剂是 ______ ;
(5)5.3g苯甲醛、![]() 乙酸酐和
乙酸酐和![]() 无水碳酸钾充分反应得到肉桂酸实际
无水碳酸钾充分反应得到肉桂酸实际![]() ,则产率是 ______
,则产率是 ______ ![]() 保留3位有效数字
保留3位有效数字![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法错误的是
A.标准状况下,22.4 L环丙烷和丙烯的混合气体中所含共用电子对数为9NA
B.56g铁在足量氧气中完全燃烧,转移的电子数小于3NA
C.16g O2和14C2H4的混合物中所含中子数为8NA
D.常温下,1 L 0.5 mol/L CH3COONH4溶液的pH=7,则溶液中CH3COO-与NH4+的数目均为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10.00 mL 0.1mol/L某二元酸H2X溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化如图所示(忽略温度变化),已知:常温下,H2X的电离常数Ka1 = 1.1×10-5 ,Ka2 = 1.3×10-8。下列叙述正确的是( )
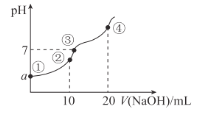
A.从点①到点④过程中水的电离程度先增大后减小
B.点②处c(Na+) + 2c(H+) + c(H2X) =2 c(X2-) + c(HX-) + 2c(OH-)
C.a近似等于3
D.点④处c(Na+) = 2 c(X2-) > c(OH-) > c(HX-) > c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳九”是在石油提炼时获得的一系列含碳数量在9左右的烃,沸点处于汽油和柴油之间。“碳九”有两种,分为裂解碳九和重整碳九,前者主要为烷烃.烯烃等链烃,后者主要为丙苯、对甲乙米等芳香烃。下列有关说法错误的是
A.若将“碳九"添加到汽油中,可能会使汽油燃烧不充分而形成积炭
B.用溴水可以区分裂解碳九和重整碳九
C.均三甲苯( )的二氯代物有5种
)的二氯代物有5种
D.异丙苯[![]() ]和对甲乙苯(
]和对甲乙苯(![]() )互为同系物
)互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年2月27日,科技日报报道中科院大连化学物理研究所创新性地提出锌碘单液流电池的概念,锌碘单液流电池中电解液的利用率达到近100% ,进而大幅度提高了电池的能量密度,工作原理如图所示。下列说法正确的是

A.该电池放电时电路中电流方向为A→a→b→B→A
B.M为阴离子交换膜,N为阳离子交换膜
C.如果使用铅蓄电池进行充电,则B电极应与铅蓄电池中的Pb电极相连
D.若充电时C区增加的离子数为2NA,则A极增重65 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示。下列说法正确的是

A.电子流向:A电极→用电器→B电极→电解质→A 电极
B.充电时,电极B与外接电源正极相连,电极反应式为 Sx2--2e-=xS
C.若用该电池在铁器上镀锌,则铁器应与B电极相连接
D.若用该电池电解精炼铜,电路中转移1mol电子时,阳极质量减少32 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语错误的是( )
A.稀盐酸溶液与稀氢氧化钠的中和热:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ· mol-1
B.FeCl3溶液水解的离子方程式:Fe3++3H2O![]() Fe (OH)3+3H+
Fe (OH)3+3H+
C.热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJ·mol-1,一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中反应生成NH3(g),则放热19.3kJ
2NH3(g) △H=-38.6kJ·mol-1,一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中反应生成NH3(g),则放热19.3kJ
D.CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g)=2CO(g)+O2(g) ΔH=+566.0 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com