
【题目】第三代太阳能电池就是铜铟镓硒CIGS等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。
(1)晶体硅中Si原子的杂化方式是___,基态Ga原子核外电子排布式为___。
(2)向硫酸铜溶液中逐滴滴加浓氨水,先出现蓝色絮状沉淀,后沉淀逐渐溶解得到[Cu(NH3)4]SO4的深蓝色透明溶液。
①NH3极易溶于水,除因为NH3与H2O都是极性分子外,还因为____。
②在[Cu(NH3)4]2+中Cu2+与NH3之间形成的化学键称为___,提供孤电子对的成键原子是___。
③[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个C1-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为___。
(3)某含铜化合物的晶胞如图所示,晶胞上下底面为正方形,侧面与底面垂直。则晶胞中每个Cu原子与____个S原子相连,含铜化合物的化学式为____。设NA为阿伏加德罗常数的值,则该晶胞的密度为___gcm3(用含a、b、NA的代数式表示)。
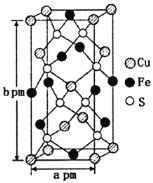
【答案】sp3 1s22s22p63s23p63d104s24p1或[Ar]3d104s24p1 NH3与H2O之间可形成分子间氢键,NH3与H2O发生反应 配位键 N 平面正方形 4 CuFeS2 ![]()
【解析】
(1)根据晶体硅中每个Si原子与周围的4个硅原子形成正四面体,向空间延伸的立体网状结构判断;Ga是31号元素,根据能量最低原理书写核外电子排布式;
(2)①氨气分子与水分子之间形成氢键,且氨气能与水反应;
②Cu2+含有空轨道,NH3中N原子含有孤电子对;
③[Cu(NH3)4]2+中的两个NH3被两个Cl-取代能得到两种不同结构的产物,[Cu(NH3)4]2+的空间构型为平面正方形;
(3)根据均摊法计算晶胞中各原子数目,确定化学式,进而计算晶胞质量,再根据![]() 计算晶胞密度。
计算晶胞密度。
(1)因晶体硅中每个Si原子与周围的4个硅原子形成正四面体,向空间延伸的立体网状结构,所以晶体硅中Si原子的杂化方式为sp3杂化。Ga位于周期表中第4周期第ⅢA族,则基态Ga原子的核外电子排布式为1s22s22p63s23p63d104s24p1或[Ar]3d104s24p1,故答案为:sp3;1s22s22p63s23p63d104s24p1或[Ar]3d104s24p1;
(2)①NH3极易溶于水,除因为它们都是极性分子外,还因为:NH3与H2O之间可形成分子间氢键,NH3与H2O发生反应,故答案为:NH3与H2O之间可形成分子间氢键,NH3与H2O发生反应;
②Cu2+含有空轨道,NH3中N原子含有孤电子对,二者形成配位键,故答案为:配位键;N;
③[Cu(NH3)4]2+中的两个NH3被两个Cl-取代能得到两种不同结构的产物,[Cu(NH3)4]2+的空间构型为平面正方形,故答案为:平面正方形;
(3)晶胞中D(S)原子位于晶胞内部,原子数目为8个,E(Fe)原子6个位于面上、4个位于棱上,E(Fe)原子数目=6×![]() +4×
+4×![]() =4,F(Cu)原子位于4个位于面上、1个内部、8个顶点上,原子数目=4×
=4,F(Cu)原子位于4个位于面上、1个内部、8个顶点上,原子数目=4×![]() +1+8×
+1+8×![]() =4,晶体中Cu、Fe、S原子数目之比=4:4:8=1:1:2,故该晶体化学式为:CuFeS2,
=4,晶体中Cu、Fe、S原子数目之比=4:4:8=1:1:2,故该晶体化学式为:CuFeS2,
晶胞质量m=![]() ×4g,晶胞体积V=(a×10-10cm)2×b×10-10cm,
×4g,晶胞体积V=(a×10-10cm)2×b×10-10cm,
晶体密度ρ=(![]() ×4g)÷[(a×10-10cm)2×b×10-10cm]=
×4g)÷[(a×10-10cm)2×b×10-10cm]=![]() gcm3,
gcm3,
故答案为:4;CuFeS2;![]() 。
。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】抗癌药物“6-Azulenol”的结构简式如图所示,下列有关叙述正确的是( )

A.分子式为C12H18O2
B.分子中含有两种官能团,能发生加成、氧化、酯化反应
C.能使溴水、酸性高锰酸钾溶液褪色,且褪色原理相同
D.lmol该物质与足量的Na反应可产生22.4LH2(标况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg与Br2反应可生成具有强吸水性的MgBr2,该反应剧烈且放出大量热。实验室采用如图装置制备无水MgBr2。已知MgBr2+3C2H5OC2H5![]() MgBr23C2H5OC2H5,MgBr23C2H5OC2H5溶于乙醚。下列说法不正确的是( )
MgBr23C2H5OC2H5,MgBr23C2H5OC2H5溶于乙醚。下列说法不正确的是( )
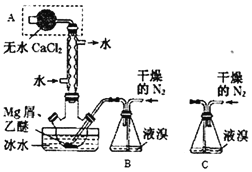
A.仪器A为干燥管,其主要作用是防止水蒸气进入反应装置
B.冷凝管的作用是导气兼起冷凝回流
C.装置B必须用干燥的N2而不能改用空气,但装置B可换成装置C
D.乙醚的作用是与MgBr2反应生成MgBr23C2H5OC2H5,并将其溶解而与Mg分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锌工业品广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,随着工业的飞速发展,我国对氧化锌的需求量日益增加,成为国民经济建设中不可缺少的重要基础化工原料和新型材料。用工业含锌废渣(主要成分为ZnO,还含有铁、铝、铜的氧化物,Mn2+、Pb2+、Cd2+等)制取氧化锌的工艺流程如图所示:

已知:相关金属离子c(Mn+)=0.1mol/L生成氢氧化物沉淀的pH如下表所示:
Fe3+ | Fe2+ | Al3+ | Mn2+ | Zn2+ | Cu2+ | Cd2+ | |
开始沉淀 | 1.5 | 6.3 | 3.4 | 8.1 | 6.2 | 6.0 | 7.4 |
沉淀完全 | 2.8 | 8.3 | 4.7 | 10.1 | 8.2 | 8.0 | 9.4 |
回答下列问题:
(1)为保证锌渣酸浸的充分,先保持酸过量,且c(H+)=0.5mol/L左右。写出一种加快锌渣浸出的方法:_______________
(2)为调节溶液的pH,则试剂X为__________________(填化学式),且调节溶液pH的范围是____________
(3)除杂时加入高锰酸钾的作用是_______________,发生反应的离子方程式为_____________
(4)“过滤”所得滤渣的主要成分是_____________________(填化学式)
(5)写出“碳化合成”的化学方程式:_____________________;“碳化合成”过程需纯碱稍过量,请设计实验方案证明纯碱过量:_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法错误的是
A.标准状况下,22.4 L环丙烷和丙烯的混合气体中所含共用电子对数为9NA
B.56g铁在足量氧气中完全燃烧,转移的电子数小于3NA
C.16g O2和14C2H4的混合物中所含中子数为8NA
D.常温下,1 L 0.5 mol/L CH3COONH4溶液的pH=7,则溶液中CH3COO-与NH4+的数目均为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
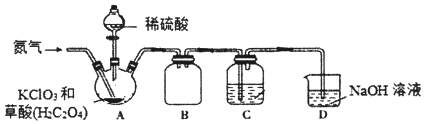
【题目】二氧化氯(C1O2)是一种黄绿色气体,沸点为11℃,不稳定,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。C1O2易溶于水但不与水反应,其水溶液在温度过高时有可能爆炸。某小组按照以下实验装置制备C1O2并验证其某些性质。
请回答下列问题:
(1)实验时A装置需要控制温度为60~80℃,则A装置加热的方式是___,该加热方式的优点是_____。
(2)通入氨气的主要作用有两个,一是可以起到搅拌作用,二是____。
(3)B装置的作用是___。C装置用来吸收C1O2,则C中液体易选用下列___(填序号)。
①热水 ②冰水 ③饱和食盐水
(4)装置D中C1O2与NaOH溶液反应可生成等物质的量的两种钠盐,其中一种为NaClO2,装置C中生成这两种钠盐的化学方程式为____。饱和NaClO2溶液在温度低于38℃时析出晶体NaC1O23H2O,在温度高于38℃时析出晶体NaClO2.请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:a.___;b.___;c.洗涤;d.干燥。
(5)设计一个简易实验证明二氧化氯具有永久的漂白性:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳九”是在石油提炼时获得的一系列含碳数量在9左右的烃,沸点处于汽油和柴油之间。“碳九”有两种,分为裂解碳九和重整碳九,前者主要为烷烃.烯烃等链烃,后者主要为丙苯、对甲乙米等芳香烃。下列有关说法错误的是
A.若将“碳九"添加到汽油中,可能会使汽油燃烧不充分而形成积炭
B.用溴水可以区分裂解碳九和重整碳九
C.均三甲苯( )的二氯代物有5种
)的二氯代物有5种
D.异丙苯[![]() ]和对甲乙苯(
]和对甲乙苯(![]() )互为同系物
)互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s)![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
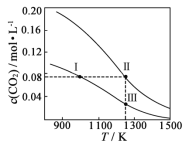
A.反应CO2(g)+C(s) ![]() 2CO(g)的ΔS>0、ΔH<0
2CO(g)的ΔS>0、ΔH<0
B.体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ)
C.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D.逆反应速率:v逆(状态Ⅰ)>v逆(状态Ⅲ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组按下列路线合成抗抑郁药物吗氯贝胺
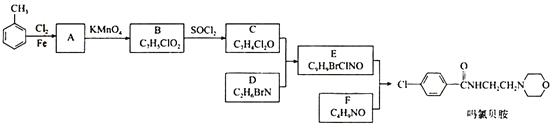
已知:
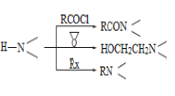
请回答:
(1)化合物B的官能团名称___________,![]() →A的反应试剂和条件是__________
→A的反应试剂和条件是__________
(2)化合物F的结构简式是______________________
(3)写出C+D→E的化学方程式____________________________________________
(4) 为探索新的合成路线,发现用化合物C与X(C6H14N2O)一步反应即可合成吗氯贝胺。请结合相关信息及知识,设计以环氧乙烷( ![]() )为原料合成X的合成路线_______________(用流程图表示,无机试剂任选)。
)为原料合成X的合成路线_______________(用流程图表示,无机试剂任选)。
(5)符合以下条件的化合物X(C6H14N2O)可能的同分异构体有___________种。其中只有一条侧链的同分异构体的结构简式为________________
①分子中有一个六元环,且成环原子中最多含一个非碳原子。
②1H-NMR谱显示分子中有5种氢原子;IR谱表明分子中有N-N键,无O-H键。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com