
【题目】Mg与Br2反应可生成具有强吸水性的MgBr2,该反应剧烈且放出大量热。实验室采用如图装置制备无水MgBr2。已知MgBr2+3C2H5OC2H5![]() MgBr23C2H5OC2H5,MgBr23C2H5OC2H5溶于乙醚。下列说法不正确的是( )
MgBr23C2H5OC2H5,MgBr23C2H5OC2H5溶于乙醚。下列说法不正确的是( )
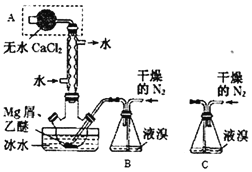
A.仪器A为干燥管,其主要作用是防止水蒸气进入反应装置
B.冷凝管的作用是导气兼起冷凝回流
C.装置B必须用干燥的N2而不能改用空气,但装置B可换成装置C
D.乙醚的作用是与MgBr2反应生成MgBr23C2H5OC2H5,并将其溶解而与Mg分离
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.某烷烃的名称为2,2,4,4-四甲基-3,3,5-三乙基己烷
B.等质量的甲醛与乳酸[CH3CH(OH)COOH]完全燃烧消耗氧气的量不相等
C.如图是某有机物分子的比例模型,该物质可能是一种氨基酸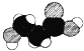
D.化合物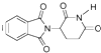 在酸性条件下水解,所得溶液加碱后加热有NH3生成
在酸性条件下水解,所得溶液加碱后加热有NH3生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100 mL 0.01 molL﹣1 HA溶液中逐滴加入0.02 molL﹣1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况,下列说法不正确的是
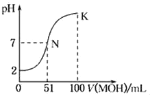
A. HA为一元强酸,MOH为一元弱碱
B. N点溶液中离子浓度大小关系为:c(M+)=c(A﹣)>c(H+)=c(OH﹣)
C. N点水的电离程度大于K点水的电离程度
D. N→K之间曲线上任意一点都有c(M+) >c(OH﹣)>c(A﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的捕集与利用是实现温室气体减排的重要途径之一。
(1)目前工业上用的捕碳剂NH3和(NH4)2CO3,它们与CO2发生如下可逆反应:
2NH3(l)+H2O(l)+CO2(g)![]() (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
NH3(l)+H2O(l)+CO2(g)![]() NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
(NH4)2CO3(aq)+H2O(l)+CO2(g)![]() 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
则ΔH3=______________(用含ΔH1、ΔH2的代数式表示)
(2)利用CO2制备乙烯是我国能源领域的一个重要战略方向,具体如下:
方法一:CO2催化加氢合成乙烯,其反应为:
2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH=a kJ·mol-1
C2H4(g)+4H2O(g) ΔH=a kJ·mol-1
起始时按n(CO2)∶n(H2)=1∶3的投料比充入20L的恒容密闭容器中,不同温度下平衡时的H2和H2O的物质的量如图甲所示:


①下列说法正确的是________;
A.该反应正反应的活化能小于逆反应的活化能
B.其它条件不变时,若压缩容器容积,则活化分子百分数增大,v正和v逆均增大
C.测得容器内混合气体平均分子量不随时间改变时,说明反应已达到平衡
D.使用合适的催化剂,催化剂改变反应历程,减小反应焓变,加快反应速率
②393K下,H2的平衡转化率为__________(保留三位有效数字);
③393K下,该反应达到平衡后,再向容器中按n(CO2)∶n(H2)=1∶3投入CO2和H2则n(H2)/n(C2H4)将__________(填“变大”或“不变”或“变小”或“无法确定”);
方法二:用惰性电极电解强酸性的二氧化碳水溶液可得到乙烯,其原理如图乙所示。
④b电极上的电极反应式为_________________________;
⑤该装置中使用的是_________________(填“阳”或“阴”)离子交换膜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用太阳能光伏电池电解水可交替制得高纯H2和O2,工作示意图如图所示。下列说法错误的是( )
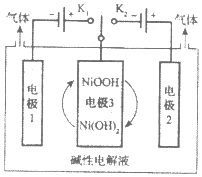
A.制H2时,连接K1;制O2时,连接K2
B.产生H2的电极反应式是2H++2e-=H2↑
C.制O2时电极3发生的电极反应为NiOOH+H2O+e-=Ni(OH)2+OH-
D.通过控制开关交替连接K1或K2,可以使电极3循环使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)H2A在水中存在以下平衡:H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-。NaHA溶液显酸性,则溶液中离子浓度的大小顺序为__________________________。
H++A2-。NaHA溶液显酸性,则溶液中离子浓度的大小顺序为__________________________。
(2)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)![]() Ca2+(aq)+A2-(aq)滴加少量Na2A固体,c(Ca2+)___(填“增大”“减小”或“不变”),原因是______。
Ca2+(aq)+A2-(aq)滴加少量Na2A固体,c(Ca2+)___(填“增大”“减小”或“不变”),原因是______。
(3)含有![]() 的废水毒性较大,某工厂废水中含4.00×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含4.00×10-3 mol·L-1的Cr2O![]() 。为使废水能达标排放,作如下处理:
。为使废水能达标排放,作如下处理:![]()
![]() Cr2+、Fe3+
Cr2+、Fe3+![]() Cr(OH)3、Fe(OH)3
Cr(OH)3、Fe(OH)3
①该废水中加入FeSO4·7H2O和稀硫酸,发生反应的离子方程式为:_______。
②若处理后的废水中残留的c(Fe3+)=1×10-13 mol·L-1,则残留的Cr3+的浓度为__________________。{已知:Ksp[Fe(OH)3]≈1.0×10-38 ,Ksp[Cr(OH)3]≈1.0×10-31}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇作为可再生能源,越来越受到人们的关注。已知甲醇制备的有关化学反应的平衡常数及焓变数据如下
化学反应 | 500℃平衡常数 | 焓变 |
①CO(g)+2H2(g) | K1=2.5 | ΔH1=-116 kJ·mol-1 |
②CO2(g)+H2(g) | K2=1.0 | ΔH2=+41 kJ·mol-1 |
③CO2(g)+3H2(g) | K3=? | ΔH3=? |
(1)反应③的K3=__,ΔH3=___。
(2)对于反应②升高温度平衡常数___(填“增大”“减小”或“不变”)。
(3)500℃时测得反应③在某时刻CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.1、0.8、0.3、0.15,则此时v正__v逆(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三代太阳能电池就是铜铟镓硒CIGS等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。
(1)晶体硅中Si原子的杂化方式是___,基态Ga原子核外电子排布式为___。
(2)向硫酸铜溶液中逐滴滴加浓氨水,先出现蓝色絮状沉淀,后沉淀逐渐溶解得到[Cu(NH3)4]SO4的深蓝色透明溶液。
①NH3极易溶于水,除因为NH3与H2O都是极性分子外,还因为____。
②在[Cu(NH3)4]2+中Cu2+与NH3之间形成的化学键称为___,提供孤电子对的成键原子是___。
③[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个C1-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为___。
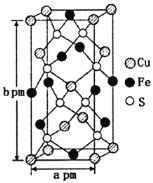
(3)某含铜化合物的晶胞如图所示,晶胞上下底面为正方形,侧面与底面垂直。则晶胞中每个Cu原子与____个S原子相连,含铜化合物的化学式为____。设NA为阿伏加德罗常数的值,则该晶胞的密度为___gcm3(用含a、b、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作或试剂选择合理的是
A.可用蒸发结晶、趁热过滤的方法提纯含少量![]() 杂质的NaCl
杂质的NaCl
B.某固体试样加水溶解,取上层清液,加KSCN溶液出现红色,原固体中一定含![]()
C.某碱性水样滴加稀盐酸无沉淀,再加![]() 溶液,出现白色沉淀,则原水样中一定含
溶液,出现白色沉淀,则原水样中一定含![]()
D.可用酸性![]() 溶液检验
溶液检验![]() 溶液中是否含有
溶液中是否含有![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com