
【题目】25℃时,向某二元弱酸H2X的钠盐溶液中滴加盐酸,混合溶液中离子浓度与pH的关系如图所示,其中lgX =lgc(X2-)/ c(HX-) 或lgc(HX-)/c(H2X)。下列叙述不正确的是

A. 当溶液呈中性时, c(HX-)>c(X2-)>c(H2X)
B. 曲线m表示lgc(X2-)/c(HX-)与pH的变化关系
C. Ka1(H2X)的数量级为10-7
D. 25℃时,NaHX溶液中:c(OH-)>c(H+)
【答案】A
【解析】
H2X为二元弱酸,以第一步电离为主,则Ka1(H2X)>Ka2(H2X),酸性条件下,则pH相同时c(HX-)/c(H2X)>c(X2-)/ c(HX-),由图象可知n为lg c(X2-)/ c(HX-)的变化曲线,m为lg c(X2-)/c(HX-)的变化曲线,据此分析解答。
A.由图可知当溶液呈中性时,![]() ,当
,当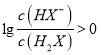 ,
,![]() ,因为水解大于电离,所以
,因为水解大于电离,所以![]() ,故A选项错误;
,故A选项错误;
B. 因为![]() 为二元弱酸,
为二元弱酸,![]() ,所以
,所以![]() 的水解程度大,碱性强,故曲线m表示
的水解程度大,碱性强,故曲线m表示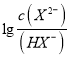 与
与![]() 的变化关系,故B选项正确;
的变化关系,故B选项正确;
C. 当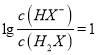 时,
时,![]() ,pH=7.4,
,pH=7.4,![]() ,此时,
,此时, ,
,![]() 的数量级为
的数量级为![]() 是正确的,故C选项正确;
是正确的,故C选项正确;
D.由图可知,![]() 时,当
时,当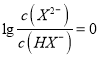 ,即
,即![]() 时,pH>9.3,溶液显碱性,所以水解大于电离,NaHX溶液显碱性,
时,pH>9.3,溶液显碱性,所以水解大于电离,NaHX溶液显碱性,![]() ,故D选项正确;
,故D选项正确;
故答案选A。


科目:高中化学 来源: 题型:
【题目】甲醇作为可再生能源,越来越受到人们的关注。已知甲醇制备的有关化学反应的平衡常数及焓变数据如下
化学反应 | 500℃平衡常数 | 焓变 |
①CO(g)+2H2(g) | K1=2.5 | ΔH1=-116 kJ·mol-1 |
②CO2(g)+H2(g) | K2=1.0 | ΔH2=+41 kJ·mol-1 |
③CO2(g)+3H2(g) | K3=? | ΔH3=? |
(1)反应③的K3=__,ΔH3=___。
(2)对于反应②升高温度平衡常数___(填“增大”“减小”或“不变”)。
(3)500℃时测得反应③在某时刻CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.1、0.8、0.3、0.15,则此时v正__v逆(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
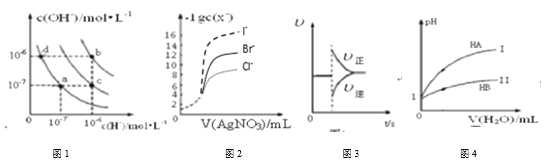
A.图1中在b点对应温度下,将pH=2的H2SO4溶液与pH=12的NaOH溶液等体积混合后,溶液显中性
B.用0.0100 mol/L硝酸银标准溶液,滴定浓度均为0.1000 mol/L Cl-、Br-及I-的混合溶液,由图2曲线,可确定首先沉淀的是Cl-
C.图3表示在N2(g)+3H2(g) ![]() 2NH3(g)达到平衡后,减小NH3浓度时速率的变化
2NH3(g)达到平衡后,减小NH3浓度时速率的变化
D.图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则等物质的量浓度的NaA和NaB混合溶液中:c(Na+)>c(A-)>c(B-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作或试剂选择合理的是
A.可用蒸发结晶、趁热过滤的方法提纯含少量![]() 杂质的NaCl
杂质的NaCl
B.某固体试样加水溶解,取上层清液,加KSCN溶液出现红色,原固体中一定含![]()
C.某碱性水样滴加稀盐酸无沉淀,再加![]() 溶液,出现白色沉淀,则原水样中一定含
溶液,出现白色沉淀,则原水样中一定含![]()
D.可用酸性![]() 溶液检验
溶液检验![]() 溶液中是否含有
溶液中是否含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)可作还原剂、着色剂、制药等,在不同温度下易分解得到各种铁的氧化物和硫的氧化物。已知SO3是一种无色晶体,熔点16.8℃,沸点44.8℃,氧化性及脱水性较浓硫酸强,能漂白某些有机染料,如品红等。回答下列问题:

(1)甲组同学按照上图所示的装置,通过实验检验绿矾的分解产物。装置B中可观察到的现象是_____________________________,甲组由此得出绿矾的分解产物中含有SO2。装置C的作用是_________________________。
(2)乙组同学认为甲组同学的实验结论不严谨,认为需要补做实验。对甲组同学做完实验的B装置的试管加热,发现褪色的品红溶液未恢复红色,则可证明绿矾分解的产物中__________(填字母)。
A.不含SO2 B.可能含SO2 C.一定含有SO3
(3)丙组同学查阅资料发现绿矾受热分解还可能有O2放出,为此,丙组同学选用甲组同学的部分装置和下图部分装置设计出了一套检验绿矾分解所得气态产物的装置:

①丙组同学的实验装置中,依次连接的合理顺序为_______________________。
②能证明绿矾分解产物中有O2的检验方法是________________________。
(4)为证明绿矾分解产物中含有三价铁的操作及现象____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】许多含氮物质是农作物生长的营养物质。
(1)肼(N2H4)、N2O4常用于航天火箭的发射。已知下列反应:
①N2(g)+O2(g) =2NO(g) ΔH=+180kJ·mol-1
②2NO(g)+O2(g)![]() 2NO2(g) ΔH=-112kJ·mol-1
2NO2(g) ΔH=-112kJ·mol-1
③2NO2(g)![]() N2O4(g) ΔH=-57kJ·mol-1
N2O4(g) ΔH=-57kJ·mol-1
④2N2H4(g)+N2O4(g) =3N2(g)+4H2O(g) ΔH=-1136kJ·mol-1
则N2H4与O2反应生成氮气与水蒸气的热化学方程式为_________________。
(2)一定温度下,向某密闭容器中充入1 mol NO2,发生反应:2NO2(g)![]() N2O4(g),测得反应体系中气体体积分数与压强之间的关系如图所示:
N2O4(g),测得反应体系中气体体积分数与压强之间的关系如图所示:
①a、b、c三点逆反应速率由大到小的顺序为_______。平衡时若保持压强、温度不变,再向体系中加入一定量的Ne,则平衡_______移动(填“正向”“逆向”或“不”)。
②a点时NO2的转化率为___________,用平衡分压代替平衡浓度也可求出平衡常数Kp,则该温度下Kp=________Pa-1。
(3)已知在一定温度下的可逆反应N2O4(g)![]() 2NO2(g)中,v正=k正c(N2O4),v逆=k逆c2(NO2)(k正、k逆只是温度的函数)。若该温度下的平衡常数K=10,则k正=______k逆。升高温度,k正增大的倍数_______(填“大于”“小于”或“等于”)k逆增大的倍数。
2NO2(g)中,v正=k正c(N2O4),v逆=k逆c2(NO2)(k正、k逆只是温度的函数)。若该温度下的平衡常数K=10,则k正=______k逆。升高温度,k正增大的倍数_______(填“大于”“小于”或“等于”)k逆增大的倍数。
(4)氨气是合成众多含氮物质的原料,利用H2-N2—生物燃料电池,科学家以固氮酶为正极催化剂、氢化酶为负极催化剂,X交换膜为隔膜,在室温条件下即实现了合成NH3的同时还获得电能。其工作原理图如下:

则X膜为___________交换膜,正极上的电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气常用作致冷剂及制取铵盐和氮肥,是一种用途广泛的化工原料。金属镓是一种广泛用于电子工业 和通讯领域的重要金属,镓元素(31Ga)在元素周期表中位于第四周期 IIIA 族,化学性质与铝元素相似。
(1)如图是当反应器中按 n(N2):n(H2)=1:3 投料后,在 200℃、400℃、600℃下,反应达到平衡时,混合物中 NH3的物质的量分数随压强的变化曲线。
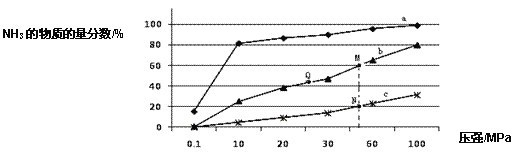
①曲线 a 对应的温度是_____________。
②关于工业合成氨的反应,下列叙述正确的是____________(填字母)。
A.及时分离出 NH3 可以提高 H2 的平衡转化率
B.根据勒夏特列原理,一般采用高温下发生反应
C.上图中 M、N、Q 点平衡常数 K 的大小关系是 K(M) = K(Q) >K(N)
③M 点对应的 H2 转化率是____________。
(2)工业上利用 Ga 与 NH3 合成固体半导体材料氮化镓(GaN)同时有氢气生成。反应中,生成 3 mol H2 时就会放出30.8 kJ 的热。
①该反应的热化学方程式是____________________。
②反应的化学平衡常数表达式是____________。
③在恒温恒容的密闭体系内进行上述可逆反应,下列有关表达正确的是____________。
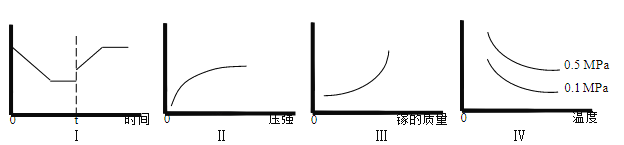
A.I 图像中如果纵坐标为正反应速率,则 t 时刻改变的条件可以为升温
B.II 图像中纵坐标可以为镓的转化率
C.III 图像中纵坐标可以为化学反应速率
D.Ⅳ图像中纵坐标可以为体系内混合气体平均相对分子质量
④氮化镓(GaN)性质稳定,但能缓慢的溶解在热的 NaOH 溶液中,该反应的离子方程式是:___________________。
(3)将一块镓铝合金完全溶于烧碱溶液中得到溶液 X。己知:
Al(OH)3 | Ga(OH)3 | |
酸式电离常数 Ka | 2×10- 11 | 1×10- 7 |
碱式电离常数 Kb | 1.3×10- 33 | 1.4×10- 34 |
往 X 溶液中缓缓通入 CO2,最先析出的氢氧化物是____________。
(4)工业上以电解精炼法提炼镓的原理如下:以待提纯的粗镓(内含 Zn、Fe、Cu 杂质)为阳极,以高纯镓为阴极,以 NaOH 水溶液为电解质溶液。在电流作用下使粗镓在阳极溶解进入电解质溶液,并通过某种离子迁移技 术到达阴极并在阴极放电析出高纯镓。
①己知离子氧化性顺序为:Zn2+<Ga3+< Fe2+<Cu2+,电解精炼镓时阳极泥的成分是____________。
②GaO2- 在阴极放电的电极方程式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种制备草酸铁铵晶体[(NH4)3Fe(C2O4)3]的工艺流程如下:
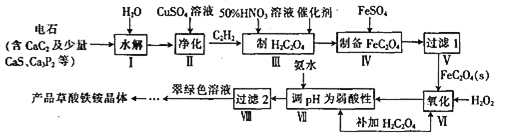
回答下列问题:
(1)CaC2的电子式为__________
(2)步骤Ⅱ主要是除去H2S、PH3等杂质气体。在除PH3时,PH3被氧化为H3PO4,CuSO4被还原为Cu,该反应中氧化剂与还原剂的物质的量之比为____________
(3)步骤Ⅲ制H2C2O4时需要加热硝酸的还原产物为NO,该反应的化学方程式为______________,硝酸的浓度及反应温度都不宜过高,是因为____________.
(4)“过滤1”需对沉淀进行洗涤检验其是否洗涤干净的依据是____________________
(5)步骤Ⅵ、VII补加草酸的目的是______________________.
(6)步骤VIII由滤液制得产品的操作为____________、____________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】扁桃酸是唯一具有脂溶性的果酸,实验室用如下原理制备:
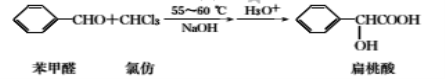
合成扁桃酸的实验步骤、装置示意图及相关数据如下:
物质 | 状态 | 熔点/℃ | 沸点/℃ | 溶解性 |
扁桃酸 | 无色透明晶体 | 119 | 300 | 易溶于热水、乙醚和异丙醇 |
乙醚 | 无色透明液体 | -116.3 | 34.6 | 溶于低碳醇、苯、氯仿,微溶于水 |
苯甲醛 | 无色液体 | -26 | 179 | 微溶于水,能与乙醇、乙醚、苯、 氯仿等混溶 |
氯仿 | 无色液体 | -63.5 | 61.3 | 易溶于醇、醚、苯、不溶于水 |
实验步骤:
步骤一:向如图所示的实验装置中加入0.1mol(约l0.1mL)苯甲醛、0.2mol(约16mL)氯仿,慢慢滴入含19g氢氧化钠的溶液,维持温度在55~60℃,搅拌并继续反应1h,当反应液的pH接近中性时可停止反应。

步骤二:将反应液用200mL水稀释,每次用20mL。乙醚萃取两次,合并醚层,待回收。
步骤三:水相用50%的硫酸酸化至pH为2~3后,再每次用40mL乙醚分两次萃取,合并萃取液并加入适量无水硫酸钠,蒸出乙醚,得粗产品约11.5g。
请回答下列问题:
(1)图中仪器C的名称是___。
(2)装置B的作用是___。
(3)步骤一中合适的加热方式是___。
(4)步骤二中用乙醚的目的是___。
(5)步骤三中用乙醚的目的是___;加入适量无水硫酸钠的目的是___。
(6)该实验的产率为___(保留三位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com