
【题目】许多含氮物质是农作物生长的营养物质。
(1)肼(N2H4)、N2O4常用于航天火箭的发射。已知下列反应:
①N2(g)+O2(g) =2NO(g) ΔH=+180kJ·mol-1
②2NO(g)+O2(g)![]() 2NO2(g) ΔH=-112kJ·mol-1
2NO2(g) ΔH=-112kJ·mol-1
③2NO2(g)![]() N2O4(g) ΔH=-57kJ·mol-1
N2O4(g) ΔH=-57kJ·mol-1
④2N2H4(g)+N2O4(g) =3N2(g)+4H2O(g) ΔH=-1136kJ·mol-1
则N2H4与O2反应生成氮气与水蒸气的热化学方程式为_________________。
(2)一定温度下,向某密闭容器中充入1 mol NO2,发生反应:2NO2(g)![]() N2O4(g),测得反应体系中气体体积分数与压强之间的关系如图所示:
N2O4(g),测得反应体系中气体体积分数与压强之间的关系如图所示:
①a、b、c三点逆反应速率由大到小的顺序为_______。平衡时若保持压强、温度不变,再向体系中加入一定量的Ne,则平衡_______移动(填“正向”“逆向”或“不”)。
②a点时NO2的转化率为___________,用平衡分压代替平衡浓度也可求出平衡常数Kp,则该温度下Kp=________Pa-1。
(3)已知在一定温度下的可逆反应N2O4(g)![]() 2NO2(g)中,v正=k正c(N2O4),v逆=k逆c2(NO2)(k正、k逆只是温度的函数)。若该温度下的平衡常数K=10,则k正=______k逆。升高温度,k正增大的倍数_______(填“大于”“小于”或“等于”)k逆增大的倍数。
2NO2(g)中,v正=k正c(N2O4),v逆=k逆c2(NO2)(k正、k逆只是温度的函数)。若该温度下的平衡常数K=10,则k正=______k逆。升高温度,k正增大的倍数_______(填“大于”“小于”或“等于”)k逆增大的倍数。
(4)氨气是合成众多含氮物质的原料,利用H2-N2—生物燃料电池,科学家以固氮酶为正极催化剂、氢化酶为负极催化剂,X交换膜为隔膜,在室温条件下即实现了合成NH3的同时还获得电能。其工作原理图如下:

则X膜为___________交换膜,正极上的电极反应式为______________________。
【答案】N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-562.5kJ·mol-1 c>b>a 逆向 66.7% 600/p0 10 大于 质子 N2+6e-+6H+=2NH3
【解析】
根据盖斯定律进行反应热的计算;根据勒夏特列原理判断平衡的移动及平衡常数的相关计算;根据原电池原理书写电极反应式。
(1)由盖斯定律知(①+②+③+④)/2即可得到N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-562.5kJ·mol-1,
故答案为:N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-562.5kJ·mol-1;
(2)①由图知,a点到c点的过程中,N2O4的体积分数不断增大,故逆反应速率不断增大。一定温度下,保持压强不变,加入稀有气体,相当于降低压强,故平衡向左移动;
②a点时,设消耗了xmolNO2,则生成0.5xmolN2O4,剩余(1-x)molNO2,1-x=0.5x,x=2/3mol,此时NO2的转化率为66.7%,平衡时p(N2O4)=0.96p0,p(NO2)=0.04p0,由此可求出Kp=600/p0;
故答案为:c>b>a;逆向;66.7%;600/p0;
(3)当反应达到平衡时,v正=v逆,即k正c(N2O4)=k逆c2(NO2)。k正=k逆c2(NO2)/c(N2O4)=k逆K=10k逆;该反应是吸热反应,升高温度,平衡向正方向移动,k正增大的倍数大于k逆增大的倍数,
故答案为:10;大于;
(4)由图知,正极上N2转化为NH3时需要结合氢离子,故负极上生成的H+应移向正极,X膜为质子交换膜或阳离子交换膜,N2在正极上得到电子后转化为NH3,
故答案为:质子;N2+6e-+6H+=2NH3。


科目:高中化学 来源: 题型:
【题目】氧化锌工业品广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,随着工业的飞速发展,我国对氧化锌的需求量日益增加,成为国民经济建设中不可缺少的重要基础化工原料和新型材料。用工业含锌废渣(主要成分为ZnO,还含有铁、铝、铜的氧化物,Mn2+、Pb2+、Cd2+等)制取氧化锌的工艺流程如图所示:

已知:相关金属离子c(Mn+)=0.1mol/L生成氢氧化物沉淀的pH如下表所示:
Fe3+ | Fe2+ | Al3+ | Mn2+ | Zn2+ | Cu2+ | Cd2+ | |
开始沉淀 | 1.5 | 6.3 | 3.4 | 8.1 | 6.2 | 6.0 | 7.4 |
沉淀完全 | 2.8 | 8.3 | 4.7 | 10.1 | 8.2 | 8.0 | 9.4 |
回答下列问题:
(1)为保证锌渣酸浸的充分,先保持酸过量,且c(H+)=0.5mol/L左右。写出一种加快锌渣浸出的方法:_______________
(2)为调节溶液的pH,则试剂X为__________________(填化学式),且调节溶液pH的范围是____________
(3)除杂时加入高锰酸钾的作用是_______________,发生反应的离子方程式为_____________
(4)“过滤”所得滤渣的主要成分是_____________________(填化学式)
(5)写出“碳化合成”的化学方程式:_____________________;“碳化合成”过程需纯碱稍过量,请设计实验方案证明纯碱过量:_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s)![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
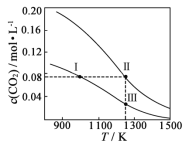
A.反应CO2(g)+C(s) ![]() 2CO(g)的ΔS>0、ΔH<0
2CO(g)的ΔS>0、ΔH<0
B.体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ)
C.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D.逆反应速率:v逆(状态Ⅰ)>v逆(状态Ⅲ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组进行电解原理的实验探究,做了如下的实验:以铜为电极,按如图所示的装置电解饱和食盐水。
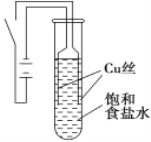
实验现象:接通电源30 s内,阳极附近出现白色浑浊,之后变成橙黄色浑浊,此时测定溶液的pH约为10。一段时间后,试管底部聚集大量红色沉淀,溶液仍为无色。
查阅资料:
物质 | 氯化铜 | 氧化亚铜 | 氢氧化亚铜 | 氯化亚铜 |
颜色 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 红色 | 橙黄色 | 白色 |
相同温度下CuCl的溶解度大于CuOH
下列说法错误的是
A.反应结束后最终溶液呈碱性
B.阴极上发生的电极反应为:2H2O + 2e═ H2↑+ 2OH
C.从实验看出氢氧化亚铜具有不稳定性
D.试管底部红色的固体具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向某二元弱酸H2X的钠盐溶液中滴加盐酸,混合溶液中离子浓度与pH的关系如图所示,其中lgX =lgc(X2-)/ c(HX-) 或lgc(HX-)/c(H2X)。下列叙述不正确的是

A. 当溶液呈中性时, c(HX-)>c(X2-)>c(H2X)
B. 曲线m表示lgc(X2-)/c(HX-)与pH的变化关系
C. Ka1(H2X)的数量级为10-7
D. 25℃时,NaHX溶液中:c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大功率的镍氢电池使用在油电混合动力车辆中。镍氢电池正极板材料为 NiOOH,负极板材料为吸氢合金(MHn), 下列关于该电池的说法中正确的的是

A.放电时电池内部H+向负极移动
B.充电时,将电池的负极与外接电源的正极相连
C.放电时负极的电极反应式为:MHn-ne- =M + nH+
D.充电时阳极反应为:Ni(OH)2 + OH- -e- =NiOOH +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
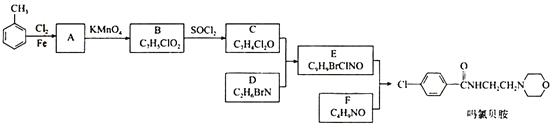
【题目】某研究小组按下列路线合成抗抑郁药物吗氯贝胺
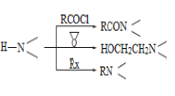
已知:
请回答:
(1)化合物B的官能团名称___________,![]() →A的反应试剂和条件是__________
→A的反应试剂和条件是__________
(2)化合物F的结构简式是______________________
(3)写出C+D→E的化学方程式____________________________________________
(4) 为探索新的合成路线,发现用化合物C与X(C6H14N2O)一步反应即可合成吗氯贝胺。请结合相关信息及知识,设计以环氧乙烷( ![]() )为原料合成X的合成路线_______________(用流程图表示,无机试剂任选)。
)为原料合成X的合成路线_______________(用流程图表示,无机试剂任选)。
(5)符合以下条件的化合物X(C6H14N2O)可能的同分异构体有___________种。其中只有一条侧链的同分异构体的结构简式为________________
①分子中有一个六元环,且成环原子中最多含一个非碳原子。
②1H-NMR谱显示分子中有5种氢原子;IR谱表明分子中有N-N键,无O-H键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu可形成多种配合物,某同学在探究配合物的形成时做了以下实验,根据下列信息回答问题:
(1)向盛有硫酸铜水溶液的试管里逐滴加入氨水,首先出现蓝色沉淀,继续滴加氨水,蓝色沉淀溶解,得到深蓝色的透明溶液,请写出先后发生反应的离子方程式___________。
(2)再向深蓝色透明溶液加入乙醇,析出深蓝色的晶体。深蓝色晶体的化学式为__________________。
(3)根据以上实验过程,判断NH3和H2O与Cu2+的配位能力:NH3________(填“>”“=”或“<”)H2O。
(4)已知Ti3+可形成配位数为6,颜色不同的两种配合物晶体,一种为紫色,另一种为绿色。两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,某同学设计了如下实验:
a、分别取等质量的两种配合物晶体的样品配成待测溶液;
b、分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c、沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的![]() 。绿色晶体配合物的化学式为____________,由Cl所形成的化学键类型是_____________。
。绿色晶体配合物的化学式为____________,由Cl所形成的化学键类型是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C是广泛存在于新鲜水果蔬菜及许多生物中的一种重要的维生素,作为一种高活性物质,它参与许多新陈代谢过程。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如下:
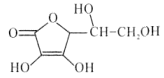 +I2
+I2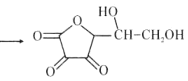 +2HI
+2HI
下列说法正确的是( )
A.上述反应说明维生素C能使碘水褪色,该反应的反应类型为取代反应
B.维生素C可发生取代反应、加成反应、氧化反应
C.维生素C可以水解得到2种产物
D.维生素C不可溶于水,可以溶于有机溶剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com