
【题目】氨气常用作致冷剂及制取铵盐和氮肥,是一种用途广泛的化工原料。金属镓是一种广泛用于电子工业 和通讯领域的重要金属,镓元素(31Ga)在元素周期表中位于第四周期 IIIA 族,化学性质与铝元素相似。
(1)如图是当反应器中按 n(N2):n(H2)=1:3 投料后,在 200℃、400℃、600℃下,反应达到平衡时,混合物中 NH3的物质的量分数随压强的变化曲线。
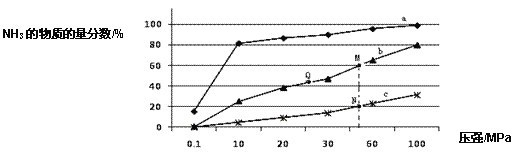
①曲线 a 对应的温度是_____________。
②关于工业合成氨的反应,下列叙述正确的是____________(填字母)。
A.及时分离出 NH3 可以提高 H2 的平衡转化率
B.根据勒夏特列原理,一般采用高温下发生反应
C.上图中 M、N、Q 点平衡常数 K 的大小关系是 K(M) = K(Q) >K(N)
③M 点对应的 H2 转化率是____________。
(2)工业上利用 Ga 与 NH3 合成固体半导体材料氮化镓(GaN)同时有氢气生成。反应中,生成 3 mol H2 时就会放出30.8 kJ 的热。
①该反应的热化学方程式是____________________。
②反应的化学平衡常数表达式是____________。
③在恒温恒容的密闭体系内进行上述可逆反应,下列有关表达正确的是____________。
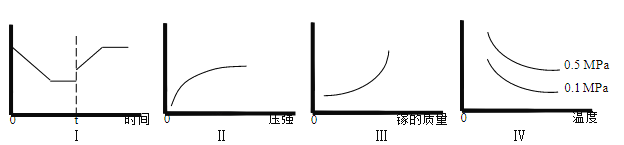
A.I 图像中如果纵坐标为正反应速率,则 t 时刻改变的条件可以为升温
B.II 图像中纵坐标可以为镓的转化率
C.III 图像中纵坐标可以为化学反应速率
D.Ⅳ图像中纵坐标可以为体系内混合气体平均相对分子质量
④氮化镓(GaN)性质稳定,但能缓慢的溶解在热的 NaOH 溶液中,该反应的离子方程式是:___________________。
(3)将一块镓铝合金完全溶于烧碱溶液中得到溶液 X。己知:
Al(OH)3 | Ga(OH)3 | |
酸式电离常数 Ka | 2×10- 11 | 1×10- 7 |
碱式电离常数 Kb | 1.3×10- 33 | 1.4×10- 34 |
往 X 溶液中缓缓通入 CO2,最先析出的氢氧化物是____________。
(4)工业上以电解精炼法提炼镓的原理如下:以待提纯的粗镓(内含 Zn、Fe、Cu 杂质)为阳极,以高纯镓为阴极,以 NaOH 水溶液为电解质溶液。在电流作用下使粗镓在阳极溶解进入电解质溶液,并通过某种离子迁移技 术到达阴极并在阴极放电析出高纯镓。
①己知离子氧化性顺序为:Zn2+<Ga3+< Fe2+<Cu2+,电解精炼镓时阳极泥的成分是____________。
②GaO2- 在阴极放电的电极方程式是___________。
【答案】200℃ AC 75% 2Ga(s) + 2NH3(g)=2GaN(s) + 3H2(g) △H=-30.8kJ/mol K=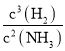 A GaN + H2O +OH-=NH3↑+ GaO2- Al(OH)3 Fe、Cu GaO2-+ 3e-+2H2O =Ga + 4OH-
A GaN + H2O +OH-=NH3↑+ GaO2- Al(OH)3 Fe、Cu GaO2-+ 3e-+2H2O =Ga + 4OH-
【解析】
(1)根据平衡移动原理及平衡常数表达式分析解答;(2)根据热化学方程式书写规范及平衡常数表达式分析解答;(3)根据平衡常数的大小比较物质的溶解性;(4)根据电解精炼原理及放电顺序分析解答。
(1)①合成氨反应放热,温度降低,平衡正方向移动,氨气的百分含量越高,所以,曲线a对应的温度是200℃,故答案为:200℃;
②A. 减小生成物浓度平衡正向移动,及时分离出NH3可以提高H2的平衡转化率,故A正确;
B. 升高温度,可以加快反应速率,但根据勒夏特列原理,升高温度,平衡逆向移动,降低了氨气的百分含量,所以不宜采用过高温度,故B错误;
C. K只受温度影响,该反应温度升高时K值减小,b是400℃,c是600℃,上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N),故C正确;故答案为:AC;
③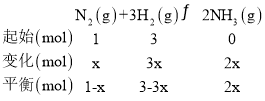
据题意M点时:![]() ,x=
,x=![]() ,则氢气的转化率为
,则氢气的转化率为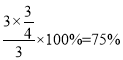 ,故答案为:75%;
,故答案为:75%;
(2)①根据热化学方程式书写规则得:2Ga(s) + 2NH3(g)=2GaN(s) + 3H2(g) △H=-30.8kJ/mol;
②该反应的平衡常数表达式为:K=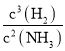 ;
;
③A.升高温度,反应速率加快,同时平衡向逆方向移动,反应物的浓度增大,正反应速率增大,当达到新的平衡,正反应速率保持不变,故A正确;
B.该反应为气体体积增大的反应,增大压强,平衡向逆反应移动,镓的转化率应该降低,故B错误;
C.镓为固体,质量增大,对反应速率基本无影响,故C错误;
D.根据反应方程式知,正反应方向混合气体的平均相对分子质量减小,升高温度,平衡逆向移动,混合气体平均相对分子质量应该增大;故D错误。
④由题干信息知,镓的化学性质与铝相似,则氮化镓(GaN)在碱性条件下水解生成氨气和GaO2-,该反应的离子方程式是:GaN + H2O +OH-=NH3↑+ GaO2-;
故答案为:2Ga(s) + 2NH3(g)=2GaN(s) + 3H2(g) △H=-30.8kJ/mol;K=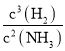 ;A;GaN + H2O +OH-=NH3↑+ GaO2-;
;A;GaN + H2O +OH-=NH3↑+ GaO2-;
(3)所得的溶液中存在平衡:H++H2O+GaO2Ga(OH)3,H++H2O+AlO2Al(OH)3,Al(OH)3的电离平衡常数更小,故溶液中通入二氧化碳,先析出Al(OH)3沉淀,故答案为:Al(OH)3;
(4)①离子氧化性顺序为:Zn2+<Ga3+< Fe2+<Cu2+,则金属还原性顺序为Zn>Ga>Fe>Cu,则阳极上Zn、Ge失电子进入电解质溶液,Fe、Cu以金属单质进入电解质溶液,则阳极泥成分是Fe、Cu,故答案为:Fe、Cu;
②②阴极上GaO2-得电子发生还原反应生成Ga,电极反应式为GaO2-+ 3e-+2H2O =Ga + 4OH-,故答案为:GaO2-+ 3e-+2H2O =Ga + 4OH-。


科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法错误的是
A.标准状况下,22.4 L环丙烷和丙烯的混合气体中所含共用电子对数为9NA
B.56g铁在足量氧气中完全燃烧,转移的电子数小于3NA
C.16g O2和14C2H4的混合物中所含中子数为8NA
D.常温下,1 L 0.5 mol/L CH3COONH4溶液的pH=7,则溶液中CH3COO-与NH4+的数目均为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示。下列说法正确的是

A.电子流向:A电极→用电器→B电极→电解质→A 电极
B.充电时,电极B与外接电源正极相连,电极反应式为 Sx2--2e-=xS
C.若用该电池在铁器上镀锌,则铁器应与B电极相连接
D.若用该电池电解精炼铜,电路中转移1mol电子时,阳极质量减少32 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向某二元弱酸H2X的钠盐溶液中滴加盐酸,混合溶液中离子浓度与pH的关系如图所示,其中lgX =lgc(X2-)/ c(HX-) 或lgc(HX-)/c(H2X)。下列叙述不正确的是

A. 当溶液呈中性时, c(HX-)>c(X2-)>c(H2X)
B. 曲线m表示lgc(X2-)/c(HX-)与pH的变化关系
C. Ka1(H2X)的数量级为10-7
D. 25℃时,NaHX溶液中:c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能得出相应结论的是
选项 | 实验操作或现象 | 实验结论 |
A | 在含 NaOH 的 Mg(OH)2 悬浊液中滴加 CoCl2 溶液,产生粉红色沉淀 | Ksp[Co(OH)2]<Ksp[Mg(OH)2] |
B | 在透明溶液中通入 CO2,产生白色胶状沉淀 | 原溶液中一定含有 SiO32- |
C | 在新制氯水中加入碳酸钙粉末,搅拌,过滤 | 氯水的漂白性会增强 |
D | 将 Fe 粉、Cu 粉分别与硫粉混合加热,分别生成 FeS、Cu2S | 还原性:Fe>Cu |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组按下列路线合成抗抑郁药物吗氯贝胺
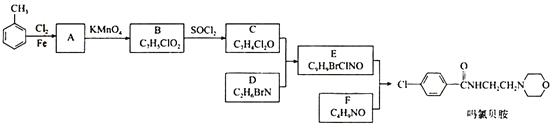
已知:
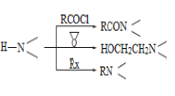
请回答:
(1)化合物B的官能团名称___________,![]() →A的反应试剂和条件是__________
→A的反应试剂和条件是__________
(2)化合物F的结构简式是______________________
(3)写出C+D→E的化学方程式____________________________________________
(4) 为探索新的合成路线,发现用化合物C与X(C6H14N2O)一步反应即可合成吗氯贝胺。请结合相关信息及知识,设计以环氧乙烷( ![]() )为原料合成X的合成路线_______________(用流程图表示,无机试剂任选)。
)为原料合成X的合成路线_______________(用流程图表示,无机试剂任选)。
(5)符合以下条件的化合物X(C6H14N2O)可能的同分异构体有___________种。其中只有一条侧链的同分异构体的结构简式为________________
①分子中有一个六元环,且成环原子中最多含一个非碳原子。
②1H-NMR谱显示分子中有5种氢原子;IR谱表明分子中有N-N键,无O-H键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语错误的是( )
A.稀盐酸溶液与稀氢氧化钠的中和热:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ· mol-1
B.FeCl3溶液水解的离子方程式:Fe3++3H2O![]() Fe (OH)3+3H+
Fe (OH)3+3H+
C.热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJ·mol-1,一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中反应生成NH3(g),则放热19.3kJ
2NH3(g) △H=-38.6kJ·mol-1,一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中反应生成NH3(g),则放热19.3kJ
D.CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g)=2CO(g)+O2(g) ΔH=+566.0 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al—Ag2O电池可用作水下动力电源,其原理如图所示。电池工作时,下列说法错误的是
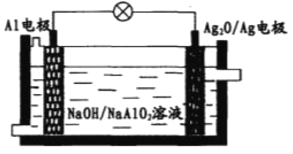
A. 电子由Al电极通过外电路流向Ag2O/Ag电极
B. 电池负极附近溶液pH升高
C. 正极反应式为Ag2O+2e-+H2O=2Ag+2OH-
D. 负极会发生副反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法正确的是( )
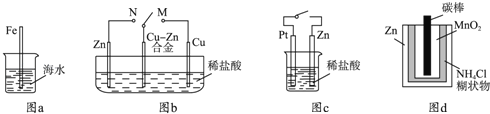
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu﹣Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn﹣MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com